
3. Культуры водорослей
Наиболее простой способ культивирования водорослей заключается в помещении их в сосуд с той же самой водой, в которой они росли в природе. Сосуды могут применяться любые, но обязательно стеклянные и лучше невысокие и широкие, чтобы была больше поверхность соприкосновения воды с воздухом (очень удобны для этой цели чашки Коха). После помещения водорослей, сосуды необходимо закрыть стеклом во избежание испарения и загрязнения воды. Водоросли помещаются в воду непосредственно в том виде, как они были собраны, т. е. в форме дерновинок, пленок, тины и т. д. Как правило, следует иметь в виду, что культура будет тем успешнее, чем меньше взято водорослей и больше воды, но, конечно, водорослей не должно быть слишком мало. При очень малом количестве меньше шансов, что среди взятого материала окажется достаточно жизнеспособных особей для роста в не совсем обычных условиях.
Сосуды с водорослями следует держать у окна, обращенного на север, северо-восток или на восток, на рассеянном свету. Выставлять культуры на прямой солнечный свет нельзя. Если имеется только южное окно, его в ясные дни необходимо занавешивать шторой из легкой материи. Ставить их удобно на подоконник и на стол перед окном, а для увеличения места полезно устроить стеллажи или полочки на кронштейнах.
Температура, при которой держат водоросли, не должна быть высокой. Летом следует остерегаться перегрева комнаты выше 15°, а зимою, когда вследствие ослабленного света водоросли вообще растут плохо, их лучше держать при значительно более низкой температуре, около 5-8°. Такой температуры можно достичь, если ставить культуры на подоконник между наружной и внутренней рамой, замазав первую и оставив незамазанной вторую. В зависимости от колебаний температуры снаружи, внутреннюю раму то приоткрывают, то закрывают, следя по термометру за температурой между рамами. Но если зимою нужно добиться быстрого роста какой-нибудь водоросли, то культуры можно выставлять на электрический свет (электролампа в 200-300 ватт), избегая только их перегрева. Для этого культуры следует располагать в некотором отдалении от источника света или стеклянную часть лампы опускать в банку с водой, меняя воду по мере ее сильного нагрева.
Основной недостаток подобного рода культур состоит в том, что, помещая в сосуды непосредственно природный материал, мы неизбежно вносим не только ту водоросль, которую желательно вырастить, но и целый ряд других, так как в природе совершенно чистые поросли одного вида встречаются крайне редко. Культуры эти являются, таким образом, смешанными. Вследствие этого иногда бывает так, что в условиях культуры начинают усиленно разрастаться те виды, которые не представляют особого интереса, формы же, ради которых материал был собран, погибают.
Для улучшения развития водорослей в культуре (особенно, если сперва наблюдался хороший рост, а затем - частичное отмирание) можно рекомендовать прибавлять в воду азотнокислые и фосфорнокислые соли, приблизительно в том же количестве, как указано ниже для искусственных питательных растворов (см. ниже).
В смешанных культурах лучше всего выживают сине-зеленые нитчатые водоросли (из класса Hormogoneae, особенно порядка осциллаториевых). Неплохо растут также мелкие зеленые хлорококковые и мелкие зеленые же нитчатки. Для развития десмидиевых водорослей следует устроить отдельный аквариум с торфянистой озерной водой, поместив в него несколько водяных растений, взятых из того же озерка, где заранее было обнаружено много этих водорослей. Диатомеи хорошо развиваются в озерном и прудовом илу, который помещают на дно небольших сосудов и заливают водой из того же водоема. Конечно, нужно брать ил, в котором этих водорослей по возможности больше. Кроме того, эпифитные диатомеи могут развиваться в аквариумах на водяных растениях и крупных нитчатках. Из крупных зеленых нитчаток культуру лучше всего переносит Cladophora, хотя в этих условиях она значительно меньше ветвится. Для других нитчаток, обрастающих различные подводные предметы, можно рекомендовать перенос в аквариум куска субстрата с порослью. Значительно труднее добиться хорошей культуры Spirogyra. Для этого ее лучше собрать поздней осенью, а зимою в лаборатории держать за окном при температуре 2-3°, не допуская, конечно, замерзания.
Что же касается планктона, то планктонные пробы в целом в живом состоянии сохранить долгое время не удается. Подавляющее большинство типично планктонных форм при описанном методе культур отмирает очень быстро, а сохраняются только второстепенные или случайные формы, преимущественно мелкие хлорококковые, некоторые десмидиевые, диатомовые и синезеленые нитчатки.
Из активно плавающих форм легче всего сохраняются живыми в культуре некоторые виды эвглен (например, Euglena gracilis). Если найдена зеленая "цветущая" лужа, в которой в массе развились эвглены, следует осторожно наполнить баночку этой водой, а затем поставить ее на окно, закрыв стеклом. Нередко эвглены в таких условиях живут довольно долго. Иногда таким же путем удается культивировать и хламидомонад. Как эвглены, так и хламидомонады хорошо развиваются также на навозной вытяжке. Для ее получения берут 100 г свежего КОНСКОГО навоза, измельчают его, доливают 5 л кипяченой воды и оставляют стоять 2-3 дня при комнатной температуре, после чего осторожно по стенкам сосуда через резиновую трубку добавляют еще 0,5 л холодной водопроводной воды. В приготовленную таким образом среду вносят эвглен или хламидомонад и выставляют сосуд на искусственный свет (М. М. Исакова-Кео, 1939).
Богатые культуры эвглен развиваются и на разведенном мясном бульоне. Он легко может быть получен, например, следующим образом (М. М. Исакова-Кео, 1939). Берут 15 г безжирного мяса, измельчают, помещают в колбу в 1 л водопроводной воды и кипятят в течение 1 часа с момента закипания. Жидкости дают отстояться и разливают в пробирки по 5-6 см3 в каждую. Пробирки затыкают ватными пробками и стерилизуют (см. ниже). Для получения культур в коническую колбу наливают 100 см3 водопроводной воды, прибавляют 1 см3 бульона и через 2-3 дня вносят каплю с эвгленами. Колбы также выставляют на искусственный свет.
Наконец, для воздушных и наземных водорослей наилучшим способом культуры будет помещение куска естественного субстрата (коры, камня, почвы) с водорослями во влажную камеру. Чрезмерно увлажнять ее не следует и лучше даже оставить щель для прохождения воздуха, чтобы избежать развития плесени.
Хороший результат дают также культуры на пластинках из гипса или необожженного фарфора.
Кроме культур на естественных средах, водоросли можно выращивать и в различных искусственно составленных питательных растворах. Этот метод применяется как для смешанных культур, так и, особенно, для культур, содержащих какой-либо один вид. Последние получить значительно труднее, но зато, будучи получены, они вполне обеспечивают наличие именно того вида, который был выделен в культуру. Остановимся сначала на методике постановки культур на искусственных питательных средах, а потом - на выделении в подобную культуру одного вида, т. е. на получении так называемых альгологически чистых культур*.
* (Альгологически чистые культуры могут быть не свободными от бактерий. Что касается получения бактериологически чистых культур водорослей (т. е. культур, не содержащих бактерий), то на имеющихся методах их получения мы не будем здесь останавливаться. Некоторые из этих методов изложены, например, в следующих статьях, специально посвященных этому вопросу: Н. С. Гаевская. О некоторых новых методах в изучении питания водных организмов. IV. Новый метод получения бактериологически чистых культур водорослей в короткие сроки времени (Бюлл. Моск. Общ. испыт. природы, отд. биологии, т. 1, вып. 2, 1946); С. В. Горюнова. Получение бактериологически чистых культур водорослей при помощи комбинированных сред (Микробиология, т. XVII, вып. 4, 1948).)
При получении таких культур применяется ряд методов, разработанных в микробиологии, на которых мы остановимся здесь очень кратко. Для более подробного ознакомления с ними следует обратиться к существующим руководствам по микробиологии*. Имеется также ряд обзорных статей и книг, специально посвященных культурам водорослей**.
* (Например, В. Л. Омелянский. Практическое руководство по микробиологии, Изд. 2-е под общей редакцией В. Л. Исаченко. Изд. Акад. наук СССР, 1940.)
** (Например, С. В. Горюнова. Культивирование водорослей в лабораторных условиях (Микробиология, т. XVII, вып. 5, 1948). )
Для культур водорослей применяются специальные колбы, выдерживающие стерилизацию высокой температурой. Лучше всего пользоваться колбами Виноградского или Креслинга, так как они обладают широким дном и узким горлышком, т. е. дают максимум поверхности воды при минимальном испарении, но, конечно, можно применять и любую другую лабораторную стеклянную посуду, до пробирок включительно (рис. 94). Для успеха культуры большое значение имеет качество стекла. Обычная стеклянная посуда нередко тормозит развитие водорослей, так как стекло часто содержит щелочи и тяжелые металлы, вымываемые водой и вредно отражающиеся на росте водорослей. Для избежания этого рекомендуется применять колбы из особо стойких сортов стекла, или, если это невозможно, перед постановкой культур подвергать посуду продолжительному воздействию раствора двухромокислого кали в концентрированной серной кислоте. Следует также иметь в виду, что для культур лучше вообще употреблять старую посуду, уже более или менее очистившуюся от нежелательных примесей.
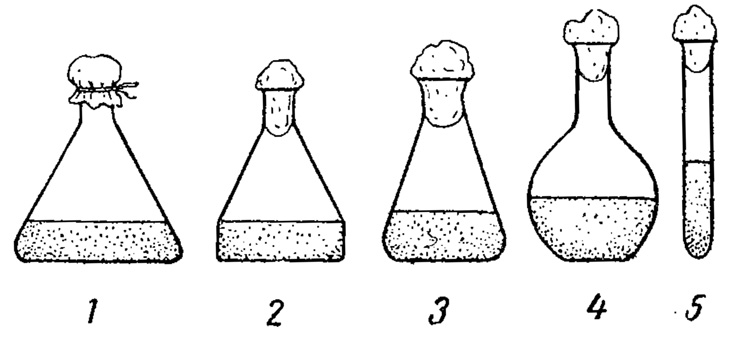
Рис. 94. Посуда для культур водорослей. 1 - колба Виноградского. 2 - колба Креслинга. 3 - колба Эрленмейера. 4 - химическая плоскодонная колба. 5 - пробирка. Первая колба показана полностью смонтированной, в остальных видно положение ватной пробки. Всюду показан уровень, до которого следует наливать питательный раствор
Колбы заполняют до определенного уровня питательным раствором, затыкают ватными пробками, горлышко поверх пробки обвертывают тонкой бумагой, обвязывая ее ниткой, и стерилизуют в автоклаве при 120° или в кипятильнике Коха при 100°, чтобы избавиться от бактерий и спор плесени, попавших из воздуха. Когда колбы простерилизованы и остыли, в них (лучше в несколько одновременно) помещают небольшое количество нужной водоросли, предварительно прополоскав ее в чистой воде, чтобы, насколько возможно, избавиться от посторонних примесей. Во избежание истощения питательного раствора, время от времени (обычно через несколько месяцев) нужно делать пересевы материала в свежую среду. Пересевы производятся специальными (лучше - платиновыми) иглами, которые каждый раз предварительно стерилизуются на пламени спиртовки. Иногда удобно пользоваться стерильными пипетками Пастера*. Культуры помещаются на естественный или искусственный свет с соблюдением всех предосторожностей, указанных выше (см. выше).
* (Пипетки готовятся путем оттягивания стеклянной трубочки в капилляр. Конец капилляра запаивается, а в широкую часть трубочки вставляется кусочек ваты. Пипетки стерилизуются в автоклаве или в кипятильнике Коха. Перед употреблением конец капилляра отламывается, и он (в целях стерилизации) прогревается в пламени спиртовки.)
Кроме водных питательных растворов многие водоросли хорошо развиваются на питательном агар-агаре, который приготовляется следующим образом*. Сухой белый агар-агар, из расчета 18-20 г на 1 л будущего раствора (1,8-2,0%), настригают мелкими кусочками и размачивают в водопроводной воде в течение 1-2 дней**. После этого разбухший агар-агар промывают в дестиллированной воде, отжимают на сите, перекладывают в колбу, вливают дестиллированной воды по расчету и варят до полного распускания на водяной бане. После варки его быстро фильтруют, пока он не остыл, через тонкий слой ваты, для чего удобно пользоваться специальной воронкой для горячего фильтрования, и прибавляют нужные соли, а затем разливают по колбам и стерилизуют, так же как и водные культуры. Посев водорослей производят на поверхности агар-агара после его застывания.
* (Агар-агар представляет собой высушенный студень, получающийся при варке богатых слизью морских красных водорослей.)
** (Лучше всего устроить так, чтобы вода непрерывно сменялась.)
Решающее значение для успеха культуры имеет выбор подходящей среды. Необходимо прежде всего иметь в виду, что аптечная дестиллированная вода, полученная в лаборатории перегонкой в обычном перегонном кубе, для культур водорослей в большинстве случаев не пригодна, тай как содержит примесь меди, губительно действующей на водоросли. Поэтому ее следует вторично перегонять через стеклянный холодильник. Если это невозможно, питательные растворы лучше готовить на природной воде - озерной, речной, колодезной и т. п., или даже на водопроводной воде. Применяемые соли должны быть химически чистыми. Соли удобнее прибавлять не в твердом виде, а в форме растворов (обычно 1-5%); зная количество соли, которое необходимо ввести в среду, нетрудно вычислить, какой объем данного раствора следует взять. Для внесения растворов солей употребляются мерные пипетки.
При выборе раствора следует максимально учитывать свойства того водоема, в котором обитает водоросль. Так, если она произрастает на торфяном болоте, - к раствору полезно прибавить (до стерилизации) отвар из торфяного мха (см. ниже) и т. п. Большого внимания заслуживает кислотность среды (pH), сильно влияющая на развитие водорослей. Поэтому рекомендуется предварительно определить pH воды того бассейна, из которого взят материал, а потом, по возможности, добиваться того, чтобы и избранная среда, в которую предположено поместить водоросль, имела близкий pH. Это достигается прибавлением к ней (по каплям) растворов щелочи (двууглекислая сода, едкое кали или едкий натр) или кислоты (серная кислота). pH определяется обычными методами. Наиболее точен электрометрический, но - при отсутствии в лаборатории соответствующей установки - он может быть с успехом заменен колориметрическим методом, для чего можно использовать, например, шкалу Михаэлиса.
Целесообразно до перенесения водорослей в колбы с раствором сначала испытать, как переносит его водоросль. Для этого можно воспользоваться обычными солонками или маленькими чашками. В них наливается испытуемая среда (предварительно простерилизованная) и в нее помещается водоросль. Солонка (или чашка) закрывается стеклом и в таком виде выставляется на свет. За состоянием водорослей можно следить, непосредственно просматривая подобные культуры под бинокуляром. Если водоросль хорошо развивается - значит среда подходит и можно переходить на культуру в колбах.
Для выявления флоры почвенных водорослей образцы почвы, собранные так, как указано выше (см. выше), или сразу помещаются в колбы (в небольшом количестве) или сначала доводятся до воздушно-сухого состояния, что применяется в тех случаях, когда пробы заготовляются в большом количестве для последующей длительной постановки культур в целях получения сравнимых данных из многих мест (часть нежных форм при высушивании почвы все же погибает). Для этого их в течение 10-14 дней выдерживают в стерильных чашках Петри со снятыми крышками, затянутых простерилизованной фильтровальной бумагой. Далее подсушенная таким образом почва просеивается через стерильное трехмиллиметровое сито и вносится в колбу с заранее простерилизованной средой. Муть скоро оседает и через 1-2 месяца обычно развивается хорошо видимая простым глазом масса водорослей.
Питательные растворы для культуры водорослей весьма разнообразны. Вообще говоря, для выращивания водорослей можно применять все основные растворы, разработанные для водных культур высших растений, но при условии разбавления их с таким расчетом, чтобы общее количество солей не превышало 0,5 г на 1 литр. Универсального раствора, в котором одинаково хорошо росли бы все водоросли, не существует, и поэтому для разных видов приходится применять различные растворы, хотя одни из них оказываются пригодными для многих, а другие - для очень ограниченного числа форм. Растворы бывают чисто минеральные и с добавлением органических веществ (белков, аминокислот, углеводов, органических кислот и т. д.). Хороший результат иногда дает прибавление к минеральному раствору почвенной вытяжки или отвара торфяного мха.
Почвенная вытяжка готовится следующим образом. 1 весовую часть сухой просеянной листовой (можно - дерновой) почвы заливают 3 частями дестиллированной воды, 3 минуты взбалтывают, а затем фильтруют через складчатый фильтр (следить, чтобы настой получился прозрачным). Торфяной отвар может быть получен путем кипячения торфяной вытяжки (250 г торфа на 1000 см3 воды) в течение 3 часов, после чего отвар фильтруется (или декантируется) и разбавляется дестиллированной водой до цвета крепкого чая.
Ниже приводятся рецепты некоторых питательных растворов для культур водорослей.
1. Наиболее простым и, вместе с тем, пригодным для многих водорослей, является следующий раствор:
Вода из того водоема, откуда взята водоросль
(профильтрованная) - 1000 см3
KNO3 - 0,2 г
K2HPO4 - 0,1 г
2. Раствор Кнопа.
Дестиллированная вода - 1000 см3
Ca(NO3)2 - 0,25 г
MgSO4 - 0,06 г
КН2РO4 - 0,06 г
КСl - 0,03 г
Fe2Cl3 - 1 капля 1%-ного раствора
Пригоден для культур многих водорослей.
3. Раствор Бенеке.
Дестиллированная вода - 1000 см3
NH4NO3 - 0,2 г
СаСl2 - 0,1 г
К2НРO4 -0,1 г
MgSO4 - 0,1 г
Fe2Cl6 - 1 капля 1%-ного раствора
Пригоден для культур разных водорослей.
4. Раствор Данилова.
Дестиллированная вода - 750 см3
Почвенная вытяжка (приготовленная, как указано выше) - 250 см3
Ca(NO3)2 - 0,2 г
К2НРO4 - 0,2 г
Употребляется для культур синезеленых водорослей, но пригоден и для других водорослей.
5. Раствор Веттштейна.
А. Дестиллированная вода - 1000 см3
(NH4)3PO4 - 0,2 г
MgSO4 - 0,05 г
СаСl2 - 0,05 г
CaSO4 - 0,05 г
K2HPO4 - 0,05 г
Fe2Cl6 - 1 капля 1%-ного раствора
Б. Торфяной отвар, приготовленный как указано выше.
Растворы А и Б смешиваются в равном количестве.
Специально применяется для культур синезеленых водорослей, собранных на торфяных болотах и вообще на кислом и бедном солями кальция субстрате.
6. Раствор Ёльманна.
Дестиллированная вода - 1000 см3
MgSO4 - 0,2 г
КН2РO4 - 0,4 г
KNO3 - 0,4 г
Рекомендуется для культивирования водорослей кислых дистрофных водоемов, в частности, десмидиевых.
7. Раствор Бристоль.
Дестиллированная вода - 1000 см3
NaNO3 - 0,25 г
КН2РO4 - 0,25 г
MgSO4 - 0,15 г
СаСl2 - 0,05 г
NaCl - 0,05 г
Fe2Cl6 - 1 капля 1%-ного раствора
Специально применяется для культур почвенных водорослей.
8. Раствор Конрада.
Дестиллированная вода - 1000 см3
(NH4)2SO4 - 0,1 г
К2НРO4 - 0,1 г
MgSO4 - 0,1 г
FeSO4 - 3 капли 1%-ного раствора
Является хорошей средой для культур некоторых эвгленовых водорослей.
9. Раствор Дюзи.
Дестиллированная вода - 1000 см3
MgSO4 - 0,2 г
КН2РO4 - 0,2 г
КСl - 0,2 г
Fe2Cl6 - 1 капля 1%-ного раствора Пептон - 2 г
Рекомендуется для культивирования некоторых эвглен (особенно, Euglena gracilis).
10. Раствор Успенского.
Дестиллированная вода - 1000 см3
СаО - 0,04 г
КН2РO4 - 0,005 г
Ca(NO3)2 - 0,005 г
MgSO4 - 0,02 г
Сначала растворяется в горячей воде СаО; после этого приливается холодная вода до необходимого объема и пропускается ток СO2 до полного растворения появившейся мути; затем добавляются остальные соли. После стерилизации раствора прибавляется железо в форме Fe2(SO4)3, исходя из расчета 1-1,5 мг Fe2O3 на 1 л воды.
Этот раствор специально применяется для культур спирогир.
Как уже указывалось выше (см. выше), при культивировании водорослей весьма желательно получение альгологически чистых культур, т. е. таких, которые содержат какой-либо один вид. Если исходная культура не была сильно засорена примесью других водорослей, этого нередко удается достигнуть последовательными пересевами, причем каждый раз стараются захватить как можно меньше и наиболее чистого материала. Однако этот метод все же не дает абсолютной уверенности в том, что мы действительно добились полной очистки. Такая уверенность, очевидно, может быть только в том случае, если перед засевом колбы мы просмотрели материал под микроскопом и непосредственно убедились в том, что он содержит одну особь или колонию. Для этого можно поступить следующим образом.
Выбирается культура, в которой интересующая нас водоросль является преобладающей. Немного материала из нее переносится в солонку или маленькую чашку и разбавляется водой (в зависимости от густоты культуры). Затем на предметное стекло накладываются мелкие покровные стекла (или их обломки), предварительно промытые спиртом. На каждое из них стеклянной палочкой или, лучше, пипеткой Пастера наносится небольшая капля жидкости с водорослями из солонки. Капли просматриваются под микроскопом (под малым увеличением) и те из них, которые содержат одну особь, с помощью пинцета переносятся в колбу с простерилизованным раствором.
Наиболее удобны, однако, те методы получения альгологически чистых культур, при которых сам процесс выделения отдельных особей контролируется под микроскопом. Из существующих приборов, с помощью которых может быть достигнут этот результат, наипростейшим является управляемая микропипетка М. М. Голлербаха (рис. 95). Она состоит из системы трех кремальер, в которой укреплена пипетка Пастера с тонко оттянутым кончиком. Широкая часть пипетки с помощью резиновой и стеклянной трубок соединена с небольшим резиновым баллоном, зажатым в винтовой зажим. Система кремальер и винтовой зажим укрепляются на обычных лабораторных штативах. Система кремальер может быть заменена съемным крестовым столиком от микроскопа (дающим два винтовых хода во взаимно-перпендикулярных направлениях) в сочетании с отдельной кремальерой (обеспечивающей передвижение пипетки в третьем направлении пространства), на которой, в несколько наклонном положении, устанавливается муфта с винтом для удержания пипетки. Эти приспособления дают возможность весьма точно перемещать кончик пипетки в пределах поля зрения микроскопа, а также поднимать или опускать его.
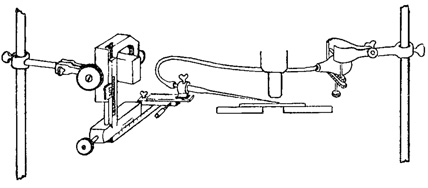
Рис. 95. Упрощенная управляемая микропипетка для выделения отдельных особей водорослей
Работа начинается с того, что капиллярная часть пипетки заполняется водой или питательным раствором до предела самопроизвольного всасывания. При соблюдении последнего условия, выделение отдельной особи сводится к подведению под кончик пипетки выбранного под микроскопом объекта (что достигается передвижением столика микроскопа) и последующему всасыванию его в капилляр путем расширения, с помощью винтового зажима, предварительно несколько сжатого резинового баллона*. Затем пипетка поднимается, под нее подводится капля воды, в которую выпускается и снова забирается объект. Повторив эту операцию несколько раз с разными каплями, легко можно отмыть водоросли от посторонних примесей. Когда это достигнуто, капля с объектом выпускается на мелкое покровное стекло (или его обломок) и переносится в колбу с раствором так, как это указано выше.
* (Работа ведется со слабым объективом. Для получения большего увеличения можно пользоваться сильным окуляром.)
|
ПОИСК:
|
© VOLIMO.RU, 2010-2019
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'