
7.2. Методы лабораторного культивирования водорослей (М. И. Радченко, Н. М. Масюк)
Метод культур все шире используют в практике таксономических [195, 639], флористических [85], гидробиологических [294] работ. Наличие чистых культур - необходимая предпосылка успешного физиолого-биохимического, цитологического и генетического изучения микроскопических водорослей.
Методы получения чистых культур
Собранный в природе живой материал служит источником получения смешанных и чистых лабораторных культур водорослей. Исходный материал, помещенный в колбе на северное окно лаборатории, может сохраняться длительное время при периодическом добавлении (в меру подсыхания) воды из исходного местообитания, стерильной водопроводной воды или подходящей питательной среды, имеющих активную реакцию (pH), как в исходной среде. Такие смешанные культуры могут быть источником живого материала в качестве контроля при изучении фиксированных формалином проб. Однако, поскольку в таких культурах присутствует смесь разных видов, которые могут вытеснять друг друга, для систематических целей желательно иметь чистые культуры исследуемых объектов.
Для выделения монадных форм и стадий обычно используют их положительный фототаксис, благодаря которому подвижные организмы скапливаются на освещенной стороне сосуда (капли), где их можно собрать с помощью пипетки. Нейстонные водоросли и синезеленые, обладающие газовыми вакуолями, отделяют от других водорослей центрифугированием, в процессе которого они скапливаются в верхних слоях жидкости. Чистую культуру некоторых видов водорослей можно получить из их покоящихся клеток (зигот, акинет, спор, цист), подвергая исходный материал воздействию экстремальных факторов (высушивая, замораживая, нагревая в термостате), разрушающих сопутствующие организмы, которые не образуют покоящихся стадий.
Для выделения отдельных организмов широко используют пипеточный метод - отлавливание единичных клеток, колонии или нитей с помощью стерильной пипетки Пастера с тонко оттянутым длинным концом под бинокулярной лупой или при малых увеличениях микроскопа. Водоросли, отловленные благодаря всасывающей силе капилляра, последовательно переносят из одной капли стерильного питательного раствора в другую, пока в капле не останется искомая водоросль без посторонних примесей, после чего ее переносят в пробирку со стерильной питательной средой и выставляют на рассеянный свет, искусственный или естественный (этот метод в отдельных случаях позволяет избавиться не только от посторонних видов водорослей, но и от сопутствующих бактерий).
Более удобным является метод агаровых пластинок. Для этой цели используют агаризованные питательные среды, содержащие 0,5-2% агар-агара. Среды, содержащие меньше 0,5% агар-агара, наиболее пригодны для изоляции нежных жгутиковых организмов, не обладающих плотными клеточными покровами. На поверхность агаровой пластинки в чашке Петри диаметром 9 см равномерно наносят 0,1 мл суспензии водорослей со средней плотностью 1 клетка в 1 мм3. На одни сутки чашки Петри помещают на рассеянный дневной свет (окно с северной стороны), а затем переносят на осветительную установку с люминесцентными лампами (освещенность около 2 тыс. лк). Отдельные колонии, выросшие на поверхности агаровой пластинки, снимают (желательно с кусочками агаровой среды) стерильными инструментами (пипеткой, препаровальной иглой, ланцетом и др.) и вносят в пробирки с жидкой питательной средой. Двукратное повторение этой процедуры позволяет не только избавиться от посторонних видов водорослей, но и получить клоповые культуры [131].
Хотя для целей систематики нет надобности в получении бактериально чистых (аксенических) культур (поскольку альгологически чистые культуры более близки к естественным условиям обитания водорослей), однако при проведении ряда физиолого-биохимических исследований возникает необходимость очистки водорослей от сопутствующих бактерий. Аксенические культуры водорослей получают с помощью антибиотиков, ультрафиолетового облучения или путем многократной проводки через стерильные агаризованные питательные среды с примесью органических веществ, способствующих проявлению бактериального загрязнения [294, 639]. Следует иметь в виду, что применение антибиотиков и ультрафиолетового облучения, оказывающих мутагенное действие, может вызвать необратимые генетические изменения изучаемой культуры.
Питательные среды
Среды, рекомендуемые для искусственного культивирования водорослей, чрезвычайно разнообразны. Выбор среды зависит от специфики культивируемого объекта и целей выращивания. Бывают жидкие среды (питательные растворы) и твердые (агаризованные). Первые используют для получения биомассы водорослей, необходимой для морфологических, цитологических, физиолого-биохимических и других исследований; вторые - для хранения коллекционных (музейных) культур*.
* (Способы хранения коллекционных культур описаны в разделе 7.3)
Большинство водорослей хорошо развивается на минеральных средах, некоторые нуждаются в добавках органических веществ, которые служат источником элементов питания, витаминов и других физиологически активных веществ. Питательные среды содержат основные биогенные элементы (N, P, S, Mg, K, Ca) и микроэлементы (Fe, Mn, Cu, Mo, Br, Zn и др.). Источником углерода служит растворенный в воде углекислый газ, запасы которого постоянно пополняются из воздуха, а также за счет его выделения водорослями в процессе дыхания или внесения в среду карбонатов и бикарбонатов. Чтобы железо и другие микроэлементы не выпадали в осадок, в среды добавляют хелатирующие соединения - органические вещества, образующие с ионами металлов устойчивые комплексные соединения в форме, доступной для питания растений, например, этилендиаминтетрауксусную кислоту (ЭДТА) или ее соли.
В качестве источника органических веществ иногда добавляют почвенную вытяжку. Существует много разных методов приготовления почвенной вытяжки. Например, Ф. Гиндак [639] рекомендует 1 часть почвы и 1 часть воды кипятить в течение 1 ч, настоять сутки, снова кипятить 1 ч, охладить, отфильтровать и фильтрат простерилизовать в автоклаве. Согласно рекомендации Э. А. III тиной [85], 1 весовую часть воздушно-сухой просеянной почвы в течение 5 мин взбалтывают с 4 частями воды, фильтруют и стерилизуют в автоклаве. Кроме почвенной вытяжки в качестве источников органических веществ добавляют пептон, глюкозу, сахарозу, аминокислоты, витамины и другие соединения.
Для приготовления питательных растворов используют дистиллированную воду, полученную из стеклянного перегонного аппарата, или простер и лизованную водопроводную воду, а также химические реактивы с достаточно высокой степенью очистки (чда).
Чтобы избежать образования осадка в питательной среде, ее компоненты лучше готовить отдельно в небольших объемах воды. Полученные растворы после стерилизации и охлаждения постепенно смешивают в необходимом объеме воды, добавляя их в той последовательности, в которой они записаны во взятом рецепте, соблюдая при этом условия стерильности. В первую очередь это касается растворов микроэлементов, фосфатов, бикарбонатов, квасцов.
Посуду и инструменты, предварительно тщательно вымытые, высушенные и завернутые в бумагу, стерилизуют и сушат в сушильном шкафу при 165-180°С в течение 2 ч. Стерилизацию раствора проводят в автоклаве сухим паром в течение 45-60 мин при давлении 9,8 ⋅ 102 ГПа. Среды, содержащие легко разрушающиеся органические вещества (сахара, витамины), стерилизуют при 4,9 ⋅ 102 ГПа 15-30 мин. Иногда применяют дробную стерилизацию текучим паром в 3-4 приема (через 2-3 суток) в аппарате Коха или в автоклаве.
Разнообразные прописи питательных сред, рекомендуемых для тех или иных групп водорослей, можно найти в многочисленных статьях и сводках [52, 175, 195, 294, 453, 639, 703]. Ниже приведены лишь некоторые из них.
Среда Киопа (г/л, применяется в разведениях 1/2, 1/4, 1/10, для зеленых водорослей):
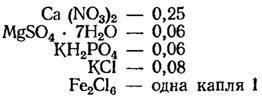
Среда Прата (г/л, для хранения коллекции культур):
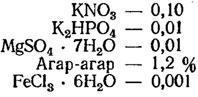
Среда Тамия (г/л, применяется в различных разведениях для зеленых водорослей):
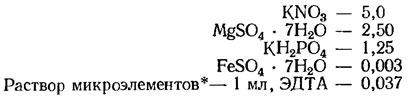
* (Раствор микроэлементов: H3BO3 - 2,86 г/л; MnCl2⋅4H2O - 1,81 г/л; ZnSO4⋅7H2O - 0,222 г/л; MoO3 - 176,4 мг/10 л; NH4VO3 - 229,6 мг/10 л.)
Среда Чу-10 (г/л, для синезеленых, зеленых и диатомовых водорослей):
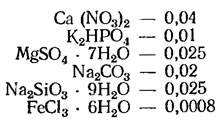
Среда Громова (мг/л; универсальная среда, применяемая в разных разведениях):
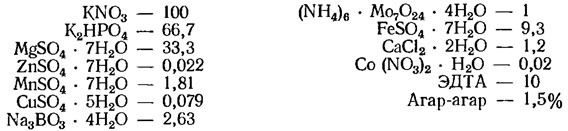
Среда Гиндака (г/л, применяется в разведениях 1/4 и 1/8 для интенсивного культивирования водорослей):
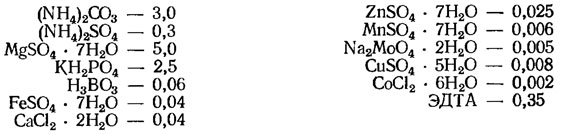
Среда Шенборна (г/л, для Euglena viridis):
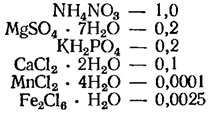
Среда Бристоль в модификации Голлербаха (г/л, для почвенных водорослей):

Среда Артари (г/л, для гипергалобных водорослей):
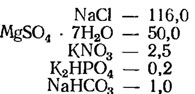
Железо-аммиачные квасцы - следы
Относительная плотность
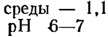
Эту же среду, разбавленную до относительной плотности 1,02, можно использовать для выращивания солоноватоводных и морских водорослей.
Среда Дрю (г/100 мл, для азотфиксирующих синезеленых водорослей):
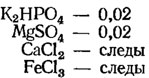
Вода дистиллированная - 100 мл
Выращивание водорослей
Все работы с чистыми культурами водорослей следует проводить с соблюдением условий стерильности, общепринятых в микробиологической практике [261]. Пересевы культур осуществляют в специальных боксах, которые перед работой стерилизуют не менее 20-30 мин с помощью бактерицидных ламп БУВ-40. Посев производят над пламенем газовой горелки или спиртовки. При отсутствии бокса посев альгологически чистых культур можно проводить в лабораторном помещении над пламенем горелки или спиртовки, следя за тем, чтобы в комнате не было движения воздуха.
Водоросли выращивают в стерильных пробирках или колбах, закрытых ватными пробками. После посева культуры выставляют на свет (окно с северной стороны или осветительные установки, например, "этажерки", снабженные люминесцентными лампами ДС-40 или ДС-80). Для изучения используют молодые, интенсивно растущие культуры водорослей на жидкой среде, которые находятся в хорошем физиологическом состоянии и не образуют уродливых форм.
|
ПОИСК:
|
© VOLIMO.RU, 2010-2019
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'