
7. Методы сбора, культивирования, изучения и хранения водорослей
7.1. Методы сбора и изучения водорослей (Н. М. Масюк, М. И. Радченко)
Существующие методы сбора и изучения водорослей многообразны. Это определяется как эколого-морфологическим своеобразием представителей различных отделов и экологических группировок, так и разнообразием целей и подходов к их изучению. Здесь не представляется возможным дать полное исчерпывающее представление о всех методах изучения водорослей, особенно тех, которые направлены на достижение специальных целей. Поэтому в данном разделе ограничимся рассмотрением лишь методов сбора и изучения водорослей континентальных водоемов для целей флористикосистематических и гидробиологических исследований.
В связи с тем, что большинство водорослей имеет микроскопические размеры, обнаружить их невооруженным глазом в естественных местообитаниях, как правило, возможно лишь при условии массового развития, вызывающего изменение окраски среды обитания: воды, почвы или другого субстрата ("цветение" воды, "цветение" почвы и др.). Обычно количество водорослей не столь значительно; однако сбор материала следует проводить даже в том случае, когда самое внимательное исследование субстрата не позволяет заметить их невооруженным глазом.
Методы сбора проб фитопланктона
Выбор метода отбора проб фитопланктона зависит от типа водоема, степени развития водорослей, задач исследования, имеющихся в наличии приборов, оборудования и т. п. С целью изучения видового состава фитопланктона при интенсивном развитии последнего достаточно зачерпнуть воды из водоема, а затем рассмотреть ее под микроскопом. Однако в большинстве случаев применяют различные методы предварительного концентрирования микроорганизмов. Одним из таких методов является фильтрование воды через планктонные сети различной конструкции (рис. 7.1).
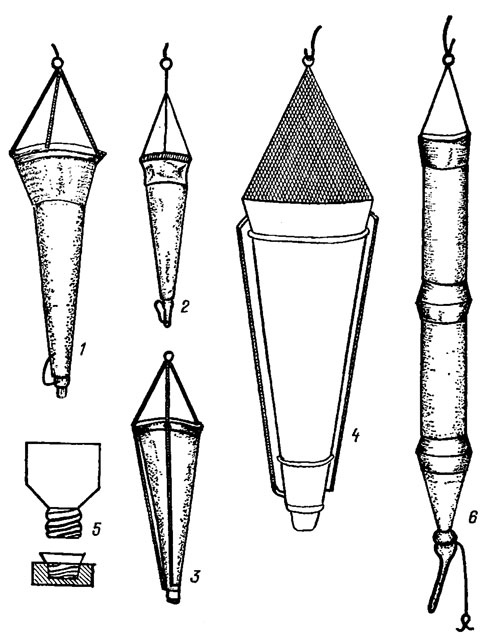
Рис. 7.1. Планктонные сети: 1-3 - сети Апштейна; 4 - сеть Берджа; 5 - стаканчик к ней; 6 - цилиндрическая сеть 'цеппелин'
Планктонная сеть состоит из латунного кольца и пришитого к нему конического мешка из мельничного шелкового или капронового сита № 77, имеющего 5929 ячей в 1 см2. Схема выкройки сетяного конуса для планктонной сети представлена на рис. 7.2. Узкое выходное отверстие конусовидного мешка плотно прикрепляется к стаканчику, имеющему выводную трубку, закрытую краном или зажимом Мора. При сборе планктона поверхностных слоев воды планктонную сеть опускают в воду так, чтобы верхнее отверстие сети находилось на расстоянии 5-10 см над ее поверхностью. Литровой кружкой черпают воду из поверхностного слоя (до 15-20 см глубины) и выливают ее в сеть, отфильтровывая таким образом 50-100 л воды. На крупных водоемах планктонные пробы отбирают с лодки. При этом рекомендуют тянуть планктонную сеть на тонкой веревке за движущейся лодкой в течение 5-10 мин.
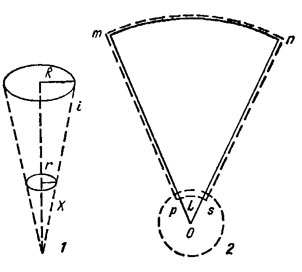
Рис. 7.2. Выкройки сетяного конуса для планктонной сети в свернутом (7) и развернутом (2) виде: R - радиус латунного кольца у входного отверстия сети; r - радиус стаканчика; ops - отрезаемая часть выкройки; i - длина бока усеченного конуса (равна длине бока сети); X - длина продолжения бока сети усеченного конуса до пересечения его с продолжением другого бока конуса; mnsp - поверхность усеченного конуса, развернутого на плоскости; О - центр дуги большой окружности, соответствующий входному отверстию сетки; L - угол между боками развернутого конуса; пунктирная линия вокруг развернутого усеченного конуса - добавочная полоска на швы (около 1 см)
Для вертикальных сборов планктона применяют сети особой конструкции [135]. На небольших водоемах планктонные пробы можно собирать с берега, постепенно заходя в воду, осторожно черпая воду кружкой впереди себя и фильтруя ее через сеть или забрасывая сеть на тонкой веревке в воду и осторожно вытягивая ее. Закончив сбор планктона, планктонную сеть прополаскивают, опуская ее несколько раз в воду до верхнего кольца, чтобы отмыть водоросли, задержавшиеся на внутренней поверхности сети. Сконцентрированную таким образом пробу планктона, находящуюся в стаканчике планктонной сети, сливают через выводную трубку в заранее приготовленную чистую баночку или бутылку. Перед началом и после окончания сбора пробы сеть необходимо хорошо прополоскать, а закончив работу, высушить и положить в специальный чехол. Сетяные пробы планктона можно изучать в живом и фиксированном состоянии.
Для количественного учета фитопланктона производят отбор проб определенного объема. Для этих целей могут быть использованы и сетяные сборы при условии обязательного учета количества отфильтрованной через сеть воды и объема собранной пробы. Однако обычно отбор проб для количественного учета фитопланктона производят специальными приборами - батометрами разнообразной конструкции (рис. 7.3). Широкое применение в практике получил батометр системы Рутнера (см. рис. 7.3, 1). Основная часть его - цилиндр, изготовленный из металла или плексигласа, емкостью 1-5 л. Прибор снабжен верхней и нижней крышками, плотно закрывающими цилиндр. Под воду батометр опускают с открытыми крышками. При достижении требуемой глубины в результате сильного встряхивания веревки крышки закрывают отверстия цилиндра, который в закрытом виде извлекают на поверхность. Заключенную в цилиндре воду через боковой патрубок, снабженный краном, сливают в приготовленный сосуд.
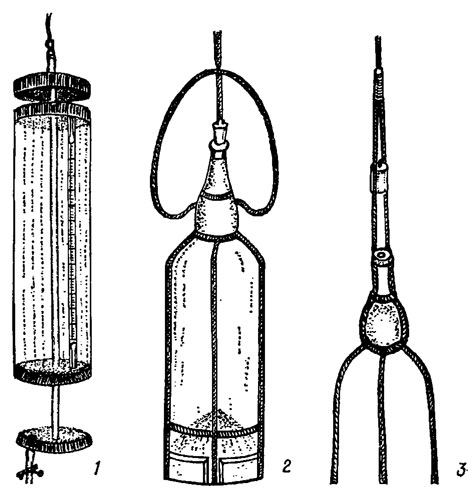
Рис. 7.3. Приборы для сбора количественных проб фитопланктона: 1 - батометр Рутнера; 2, 3 - сосуд Мейера (опускается в воду в закрытом виде - 2; при достижении определенной глубины открывается рывком за трос, прикрепленный к пробке, и после заполнения его водой поднимается в открытом состоянии - 3)
При изучении фитопланктона поверхностных слоев воды пробы отбирают, зачерпывая воду в сосуд определенного объема. В водоемах с бедным фитопланктоном желательно отбирать пробы объемом не менее 1 л параллельно с сетевыми сборами, позволяющими улавливать малочисленные, сравнительно крупные объекты. В водоемах с богатым фитопланктоном объем количественной пробы можно уменьшить до 0,5 л и даже до 0,25 л (например, при "цветении" воды).
Сгущение количественных проб фитопланктона можно осуществлять двумя методами, дающими примерно одинаковые результаты - осадочным и фильтрационным. Сгущение проб осадочным методом проводят после их предварительной фиксации и отстаивания в темном месте в течение 15-20 дней путем отсасывания среднего слоя воды с помощью стеклянной трубки, один конец которой затянут мельничным ситом № 77 в несколько слоев, а второй соединен с резиновым шлангом. Отсасывание проводят очень медленно и осторожно, чтобы не допустить нарушения осадка и засасывания поверхностного слоя пробы. Сгущенную таким способом пробу взбалтывают и, замерив ее объем, переносят в сосуд меньшего размера.
При сгущении проб фильтрационным методом используют "предварительные", а при необходимости (если размеры планктонных организмов очень малы) и бактериальные фильтры. При этом пробы воды предварительно не фиксируют, и фитопланктон изучают в живом состоянии. Для длительного хранения фильтр с осадком фиксируют в определенном объеме жидкости.
Методы сбора проб фитобентоса
Существующие методы отбора проб фитобентоса предусматривают сбор водорослей, обитающих на поверхности донных грунтов и отложений, в их толще (глубиной до 1 см) и в специфическом придонном слое воды толщиной 2-3 см. Для изучения видового состава фитобентоса достаточно извлечь на поверхность некоторое количество донного грунта с отложениями. На мелководье (до 0,5-1,0 м глубины) это достигается с помощью опущенной на дно пробирки или сифона - резинового шланга со стеклянными трубками на концах, в который засасывают наилок (рис. 7.4, 1). На больших глубинах качественные пробы отбирают с помощью ведерка или стакана, прикрепленного к палке, а также различными грабельками, "кошками", драгами, дночерпателями, илососами, из которых наиболее прост в изготовлении и удобен в работе илосос Перфильева (рис. 7.4, 2). Основная часть этого прибора - U-образная трубка с неравными концами. К короткому концу трубки подведена тонкая металлическая трубочка, к которой присоединен длинный резиновый шланг с зажимом на свободном конце. На этом же конце U-образной трубки с помощью резиновой пробки закреплена широкогорлая склянка. На длинном открытом конце трубки прикреплен груз. Прибор с помощью веревки опускают на дно водоема, где под действием груза длинный конец U-образной трубки врезается в толщу донных отложений; после этого конец резинового шланга, оставшийся на поверхности, освобождают от зажима, давая выход воздуху, и ил с силой засасывается в банку через длинный конец трубки. Затем прибор извлекают на поверхность, и содержимое банки переносят в приготовленную для пробы посуду. Для отбора количественных проб фитобентоса используют микробентометр Владимировой. Основная часть его - латунная трубка длиной 25- 30 см с внутренним диаметром 4-5 см, на основании которого рассчитывают площадь внутреннего сечения трубки. На верхнем конце этой трубки находится втулка с конусообразной воронкой, в которую на рычаге герметически входит притертая крышка-клапан (рис. 7.5). Трубку с открытой крышкой на разборной деревянной штанге опускают на дно и врезают заточенным нижним концом в толщу донного грунта на несколько сантиметров. Потянув за веревку, закрепленную на свободном конце рычага, закрывают верхнюю втулку трубки крышкой, после чего прибор осторожно извлекают на поверхность. При выходе трубки из воды нижнее отверстие трубки закрывают ладонью, чтобы не допустить выпадения грунта. Открыв крышку, осторожно сливают верхние слои воды в стеклянную посуду до появления мути. Эту первую порцию воды, содержащую планктонные организмы, выливают за борт. Оставшиеся в трубке воду, или грунт легко встряхивают и переносят в приготовленную для пробы посуду, предварительно замерив ее объем. Микробентометр Владимировой удобен в работе на глубинах 2,0-2,5 м.
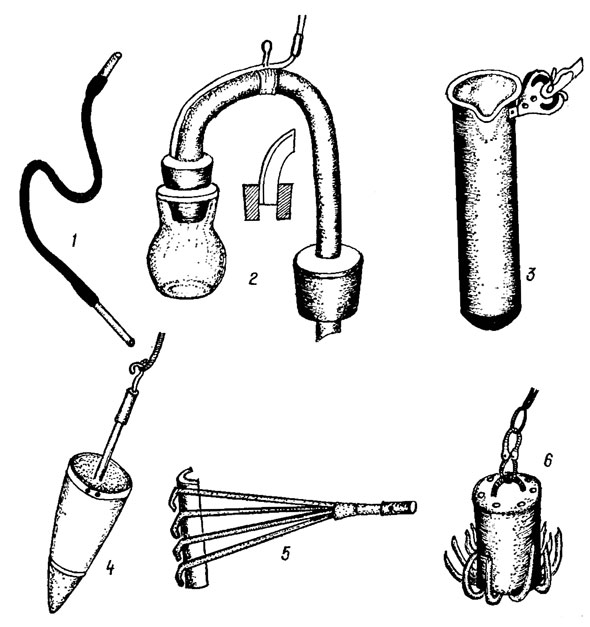
Рис. 7.4. Приборы для сбора проб фитобентоса: 1 - сифон; 2 - илосос Перфильева; 3 - стакан для ила; 4 - ведро для ила; 5 - грабельки; 6 - 'кошка'
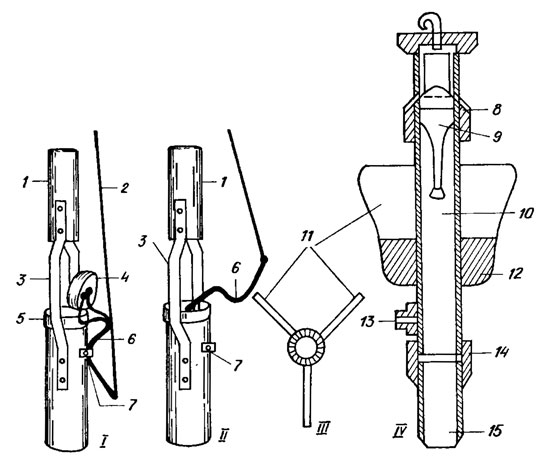
Рис. 7.5. Микробентометры Владимировой в открытом (I) и закрытом (II) виде и Травянко и Евдокимовой в поперечном (III) и продольном (IV) сечении: 1 - железная трубка, соединяющаяся с разборной штангой; 2 - шнур; 3 - кронштейн; 4 - крышка-клапан; 5 - втулка с конусом; 6 - рычаг; 7 - зажим-пружина; 8 - клапанная коробка; 9 - клапан; 10 - основное тело микробентометра; 11 - лопасти стабилизатора; 12 - свинцовый груз; 13 - штуцер для слива придонного слоя воды; 14 - переходная муфта; 15 - трубчатый нож
Более совершенная модель микробентометра, позволяющая отбирать пробы с любых глубин, предложена В. С. Травянко и Л. В. Евдокимовой (рис. 7.5). Микробентометр Травянко и Евдокимовой состоит из трубки длиной 30-35 см с внутренним диаметром 5-6 см, снабженной в верхней части автоматически работающим клапаном стабилизатора. На мерной веревке трубку с открытым клапаном в вертикальном положении опускают за борт лодки. Под действием закрепленного на приборе груза трубка врезается в толщу дна, при этом клапан герметически запирает верхнее отверстие. С помощью веревки прибор извлекают на поверхность; при выходе его из воды нижнее отверстие трубки закрывают ладонью. Затем верхний слой воды сливают за борт через боковой патрубок, а трубку, содержащую монолит грунта и остаток воды, отвинчивают от стабилизатора с клапанной коробкой, встряхивают, и замерив объем, переносят пробу в приготовленную для нее посуду.
Методы сбора проб перифитона
Для изучения видового состава перифитона налет на поверхности разнообразных подводных предметов (гальки, щебня, камней, стеблей и листьев высших водных растений, раковин моллюсков, деревянных и бетонированных частей гидротехнических сооружений и др.) снимают с помощью обычного ножа или специальных скребков и ложек (рис. 7.6). Однако при этом гибнет много интересных организмов. Часть их уносится токами воды, органы (органеллы) прикрепления водорослей к субстрату разрушаются, нарушается картина взаимного размещения компонентов биоценоза. Поэтому лучше собирать водоросли вместе с субстратом, который полностью или частично осторожно извлекают на поверхность воды так, чтобы течение не смыло с него водоросли. Извлеченный субстрат (или его фрагмент) вместе с водорослями помещают в приготовленный для пробы сосуд и заливают либо небольшим количеством воды из этого же водоема с целью дальнейшего изучения собранного материала в живом состоянии, либо 4%-м раствором формальдегида.
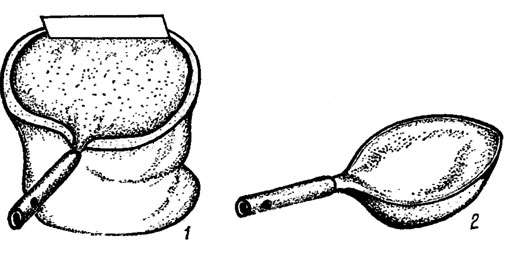
Рис. 7.6. Приспособления для отбора проб перифитона: 1 - сачок со скребком; 2 - ложка
Для количественного учета перифитона водоросли тщательно смывают с поверхности извлеченного субстрата с помощью воды и щетки над широким сосудом (кюветой, тазом), и, замерив объем смыва, переносят его в приготовленную для пробы посуду. Кроме объема смыва для количественного учета перифитона необходимо знать также площадь субстрата, с которой смыты водоросли. Для этого указанную поверхность накрывают влажной тканью и обрисовывают ее контуры чернильным карандашом. Расчет площади производят методом средневзвешенных площадей: полученный контур поверхности субстрата переводят на кальку и вырезают; из этой же бумаги вырезают квадрат со стороной 1 см (площадью 1 см2) и взвешивают. Зная массу бумажного квадрата и массу вырезанного из той же бумаги контура, рассчитывают искомую площадь.
При изучении эпифитных водорослей, смытых со стеблей листьев высших водных растений, количественный учет ведется в расчете не только на единицу площади, но и на единицу массы (сырой и воздушно-сухой) растения-субстрата. Для этого участок растения, с поверхности которого смыты эпифиты, взвешивают, затем высушивают до воздушно-сухого состояния и снова взвешивают.
Методы сбора наземных и почвенных водорослей
Наземные водоросли, образующие различно окрашенные налеты и пленки на деревьях, скалах, камнях, сырой земле, крышах и стенах домов и т. п., собирают по возможности вместе с субстратом в стерильные бумажные пакеты или в стеклянные сосуды с 4%-м раствором формальдегида. Методы сбора и изучения почвенных водорослей описаны в специальной литературе [85].
Этикетирование и фиксация проб, ведение полевого дневника
Весь собранный материал делят на две части с целью дальнейшего изучения водорослей в живом и фиксированном состоянии. Живой материал помещают в стерильные стеклянные сосуды, пробирки, колбы, баночки, закрытые ватными пробками, не заполняя их доверху, или в стерильные бумажные пакеты. Для сохранения водорослей в живом состоянии в экспедиционных условиях водные пробы упаковывают во влажную оберточную бумагу и помещают в ящики. Периодически пробы распаковывают и выставляют на рассеянный дневной свет для поддержания фотосинтетических процессов и обогащения кислородом. Несмотря на все предосторожности, не весь собранный материал удается сохранить, поэтому для работы с живым материалом краткие экскурсионные выезды более благоприятны, чем продолжительные экспедиции.
Материал, подлежащий фиксации, помещают в чисто вымытую и высушенную нестерильную стеклянную посуду (пробирки, бутылки, баночки), плотно закрытую резиновыми или корковыми пробками. Водные пробы фиксируют 40%-м формальдегидом, который добавляют к пробе в соотношении 1:10. Водоросли, находящиеся на твердом субстрате (на бумажных фильтрах, гальке, пустых раковинах моллюсков и т. п.), заливают 4%-м раствором формальдегида. Хорошую сохранность водорослей и их окраски обеспечивает также раствор формальдегида и хромовых квасцов (5 мл 4%-го формальдегида и 10 г K2SО4 ⋅ Cr2(SО4)3 ⋅ 24Н2О в 500 мл воды). В полевых условиях можно также использовать раствор иода с иодидом калия (10 г KI растворяют в 100 мл воды, добавляют 3 г кристаллического иода и еще 100 мл воды, встряхивают до полного растворения кристаллов, хранят в темной склянке в течение нескольких месяцев), который добавляют к пробе в соотношении 1:5. Герметически закупоренные фиксированные пробы можно хранить в темном месте в течение длительного времени.
Все собранные пробы тщательно этикетируют. На этикетках, заполняемых простым карандашом или пастой, несмываемой водой, указывают номер пробы, время и место сбора и фамилию сборщика. Эти же данные параллельно фиксируют в полевом дневнике, в который, кроме того, заносят результаты измерений pH, температуры воды и воздуха, схематический рисунок и подробное описание исследуемого водоема, развивающейся в нем высшей водной растительности и другие наблюдения.
Методы качественного изучения материала
Собранный материал предварительно просматривают под микроскопом в живом состоянии в день сбора, чтобы отметить качественное состояние водорослей до наступления изменений, вызванных хранением живого материала или фиксацией проб (образование репродуктивных клеток, переход в пальмеллевидное состояние, разрушение клеток, колоний, потеря жгутиков и подвижности и т. д.). В дальнейшем собранный материал продолжают изучать параллельно в живом и фиксированном состоянии. Работа с живым материалом является необходимым условием успешного изучения водорослей, изменяющих при фиксации форму тела, форму и окраску хлоропластов, теряющих жгутики, подвижность или даже полностью разрушающихся в результате воздействия фиксаторов. Чтобы сохранить собранный материал живым, следует всячески оберегать его от перегрева, загрязнения фиксаторами, а к изучению приступать как можно скорее.
Водоросли в живом состоянии в зависимости от их размеров и других особенностей изучают с помощью бинокулярной стереоскопической лупы (МБС-1) или чаще с помощью световых микроскопов различных марок с использованием разных систем окуляров и объективов, в проходящем свете или методом фазового контраста, с соблюдением обычных правил микроскопирования.
Для микроскопического изучения водорослей готовят препараты: на предметное стекло наносят каплю исследуемой жидкости и накрывают ее покровным стеклом. Если водоросли обитают вне воды, их помещают в каплю водопроводной воды или оводненного глицерина. При длительном изучении препарата жидкость под покровным стеклом постепенно подсыхает, и ее следует добавлять. Для уменьшения испарения по краям покровного стекла наносят тонкий слой парафина.
При необходимости длительных наблюдений над одним и тем же объектом хороший результат дает метод висячей капли. На чистое покровное стекло наносят маленькую каплю исследуемой жидкости, после чего покровное стекло, края которого покрыты парафином, парафиновым маслом или вазелином, накладывают каплей вниз на специальное предметное стекло с лункой посередине так, чтобы капля не касалась дна лунки (рис. 7.7). Такой препарат можно изучать в течение нескольких месяцев, сохраняя его в перерывах между работой во влажной камере.
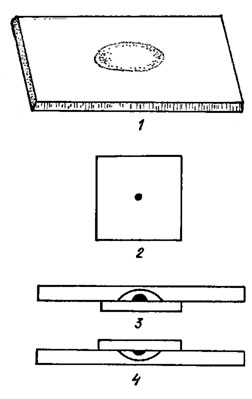
Рис. 7.7. Приготовление препарата методом висячей капли: 1 - предметное стекло с лункой; 2 - покровное стекло с нанесенной на него каплей исследуемой жидкости; 3 - покровное стекло с каплей, накрытое предметным стеклом; 4 - готовый препарат
При изучении водорослей, имеющих монадную структуру, серьезной помехой служит их подвижность. Однако при подсыхании препарата движение постепенно замедляется и приостанавливается. Замедлению движения способствует также осторожное нагревание препарата или добавление вишневого клея. Подвижные водоросли рекомендуется фиксировать парами оксида осмия (IV) (при этом хорошо сохраняются жгутики), кристаллического иода (фиксация парами иода позволяет не только сохранить жгутики, но и окрасить крахмал, если он есть, в синий цвет, что имеет диагностическое значение), 40%-го формальдегида, слабым раствором хлоралгидрата или хлороформом. Длительность экспозиции над парами фиксаторов устанавливают экспериментально, в зависимости от специфики объекта. Наиболее удобны для изучения слабо фиксированные препараты, в которых часть водорослей потеряла подвижность, а другие продолжают медленно двигаться. Препараты следует изучать немедленно после фиксации, так как в течении короткого периода времени водоросли (особенно лишенные клеточных оболочек) деформируются.
Во многих случаях кроме сравнительно-морфологического анализа признаков прибегают к цитологическим методам изучения материала. При изучении внутриклеточных структур, особенно у мелких жгутиковых, применяют прижизненное окрашивание с помощью слабых (0,005-0,0001%-х) растворов нейтрального красного, метиленового голубого, нейтрального голубого, трипанового красного, бриллианткрезилового синего, конго красного, зелени Януса, позволяющих более четко выявить клеточную оболочку, папиллы, слизь, вакуоли, митохондрии, аппарат Гольджи и другие органеллы.
Многие красители дают хороший результат лишь после применения специальных методов фиксации (при изучении фиксированных формальдегидом проб успешное применение красителей возможно только после тщательного отмывания исследуемого материала дистиллированной водой). Самый лучший фиксатор для цитологического исследования водорослей, в том числе изучения их ультраструктуры - 1-2%-й раствор оксида осмия (IV) (раствор не подлежит длительному хранению). Водоросли, не имеющие клеточных оболочек, хорошо и быстро фиксируются метанолом. Раствор Люголя (1 г иодида калия и 1 г кристаллического иода в 100 мл воды) не только хорошо фиксирует водоросли, но и одновременно окрашивает крахмал в синий цвет.
Окраска ядер. Для изучения ядер успешно используют спиртово-уксусный фиксатор Кларка (3 части 96%-го этилового спирта и 1 часть ледяной уксусной кислоты) или жидкость Карнуа (6 частей 96%-го этилового спирта, 3 части хлороформа и 1 часть ледяной уксусной кислоты). Водоросли выдерживают в свежеприготовленном растворе фиксатора в течение 1-3 ч, затем промывают 96%-м этиловым спиртом (2 мин) и водой (10 мин). Следует подчеркнуть, что при цитологическом изучении водорослей в большинстве случаев в зависимости от специфики объектов экспериментальным путем подбирают наиболее эффективные фиксаторы, красители и время экспозиции.
При окраске ядер ацетокарминовым методом предварительной фиксации спиртово-уксусным фиксатором подвергаются лишь водоросли, обладающие толстыми клеточными оболочками. Для подготовки красителя 2 г кармина кипятят в 400 мл 45%-й ледяной уксусной кислоты в течение 4 ч, пользуясь обратным холодильником. При отсутствии последнего можно использовать обычную стеклянную воронку. Полученный темно-красный раствор охлаждают, фильтруют и хранят неограниченно долго в сосуде из темного стекла. В каплю воды с водорослями на предметном стекле добавляют немного красителя, накрывают покровным стеклом и наблюдают окрашивание под микроскопом. Иногда для лучшего окрашивания препарат осторожно нагревают над пламенем газовой горелки, не допуская кипения жидкости под покровным стеклом. Кроме ядер окрашиваются базальные тела жгутиков, вакуоли и пиреноиды.
Для изучения митоза и цитохимического выявления ДНК незаменима реакция Фельгена, вызывающая красное окрашивание ядерного хроматина; при этом остальная часть цитоплазмы остается бесцветной. Для проведения реакции Фельгена готовят три раствора. Раствор А: 82,5 мл концентрированной соляной кислоты смешивают с 1000 мл дистиллированной воды. Раствор Б (реактив Шиффа): 1 г основного фуксина растворяют в 200 мл кипящей воды, охлаждают до 50°С, фильтруют, добавляют 20 мл раствора А и после охлаждения до 25°С растворяют 1 г безводного Na2SО4, а затем вносят 300 мг активированного угля; через 24 ч этот раствор должен полностью обесцветиться, если он сохраняет желтую окраску, следует приготовить новый раствор. Раствор В: 200 мл воды смешивают с 10 мл 10%-го Na2SО4 и 10 мл раствора А.
После обработки спиртово-уксусным фиксатором материал погружают на 6-8 мин (время экспозиции подбирают экспериментально) в раствор А, нагретый до 60°С, затем на мгновенье - в холодный раствор А, ополаскивают водой и погружают на 1 ч в раствор Б; затем после трехкратного промывания раствором В прополаскивают водой и готовят постоянный препарат. Следует заметить, что у некоторых водорослей, например видов родов Spirogyra Link, Oscillatoria Vauch., ДНК в присутствии реактива Шиффа дает очень слабую реакцию Фельгена.
Довольно часто для окрашивания ядер водорослей применяют гематоксилин. Свежеприготовленные растворы гематоксилина не обладают красящей способностью. Она проявляется спустя некоторое время после "созревания" раствора, при котором происходит окисление гематоксилина. Наиболее часто для водорослей используют гематоксилин Гейденгайна и гематоксилин Делафильда. Первый краситель созревает достаточно быстро, приготовление второго занимает несколько месяцев. Для окраски гематоксилином Гейденгайна готовят два раствора. Раствор А содержит 2,5 г железоаммиачных квасцов в 100 мл воды, раствор Б - 10 мл 10%-го спиртового раствора гематоксилина (на абсолютном этиловом спирте) в 90 мл воды. Раствор Б должен иметь интенсивную винно-красную окраску. Промытый после фиксации материал протравливают в течение 6-12 ч (в зависимости от специфики объекта) в растворе А, а затем быстро прополаскивают дистиллированной водой и окрашивают в растворе Б в течение 12-24 ч (также в зависимости от объекта). Поле окраски материал дифференцируют при постоянном контроле в растворе А, затем опять быстро ополаскивают дистиллированной водой и промывают в воде в течение 10-30 мин. Хроматиновые структуры ядер, базальные тела жгутиков и митохондрии окрашиваются в черный цвет (рис. 7.8, 1).
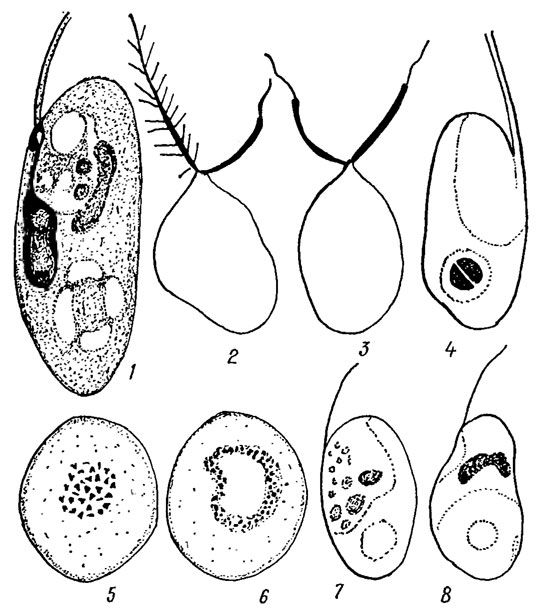
Рис. 7.8. Цитохимические реакции: 1 - окраска ядра, базального тела жгутика, разопласта и митохондрии гематоксилином Гейденгайна в клетке Pedinomonas minor Korsch.; 2 - структура жгутиков у зооспоры желтозеленой водоросли после окраски по Лефлеру; 3 - структура жгутиков у зооспоры зеленой водоросли после окраски тем же методом; 4 - окраска пиреноида уксусным азокармином в клетке Pedinomonas minor Korsch.; 5, 6 - окраска крахмальных зерен хлоралом иода у Actinochloris sphaerica Korsch. (вид сверку в оптическом разрезе); 7 - окраска капель масла суданом III в клетке Pedinomonas minor Korsch.; 8 - окраска митохондрии зеленью Януса в клетке Pedinomonas minor Korsch
Метод Гимза позволяет дифференцированно окрашивать ядра и другие клеточные органеллы. Водоросли, лишенные клеточной оболочки, фиксируют метанолом или оксидом осмия (IV); остальные окрашивают после гидролиза оксидом хлороводорода. Перед окрашиванием рекомендуется в течение нескольких минут подвергать материал воздействию 1 н. НСl при 60°С. Затем кислоту тщательно отмывают дистиллированной водой. Для окраски используют разбавленный краситель: 1-2 капли основного красителя в 1 мл воды; время окрашивания 20-60 мин. Окрашенные препараты быстро ополаскивают дистиллированной водой, проводят через безводный ацетон, смесь ацетона и ксилола в соотношении 2:1, ацетона и ксилола в соотношении 1:2, ксилол и заключают в кедровое масло. Ядерный хроматин и хромосомы окрашиваются в красный - красно-фиолетовый цвет, ядрышки - в синий, хлоропласты - в светло-синий (пиреноиды остаются бесцветными), а жгутики и их базальные тела - в светло-красный цвет.
Окраска клеточной оболочки. Для изучения химической природы клеточной оболочки используют 0,01%-й раствор рутина красного (реактив на пектиновые вещества) и хлор-цинк-иод (20 г хлорида цинка, 6,5 г иодида калия, 1,3 г кристаллического иода в 10,5 мл воды), окрашивающий целлюлозу в синий цвет. Для выявления структуры поверхности клеточной оболочки и папилл пользуются 0,1%-м водным раствором генцианвиолета, хорошо окрашивающим также слизь. Для обнаружения слизи, кроме того, применяют тушь, которая, не проникая внутрь слизи, делает ее хорошо заметной. Детали структуры поверхности клеточных покровов хорошо видны в 5%-м водном растворе нигрозина. Для изучения строения клеточных оболочек нитчатых водорослей их обрабатывают раствором КОН, а затем окрашивают конго красным.
Окраска жгутиков. Жгутики изучают в световом микроскопе с помощью окраски по Лефлеру. Для этого материал фиксируют оксидом осмия (IV), на короткое время погружают в абсолютный спирт и оставляют высохнуть. Затем добавляют несколько капель красителя (смесь 100 мл 20%-го водного раствора танина, 50 мл насыщенного водного раствора FeSО4 и 10 мл насыщенного спиртового раствора основного фуксина) и нагревают над пламенем горелки, не доводя до кипения, до появления пара. После ополаскивания дистиллированной водой препарат в течение 10 мин докрашивают карболфуксином (100 мл 5%-го водного раствора свежеперегнанного фенола и 10 мл насыщенного спиртового раствора фуксина основного; смесь отстаивают в течение 48 ч, фильтруют и хранят в течение длительного времени), затем снова ополаскивают дистиллированной водой, дают высохнуть и заключают в канадский бальзам. Этим методом можно установить наличие или отсутствие на жгутиках волосков (рис. 7.8, 2, 3). Наблюдения над длиной жгутиков, характером их движения, местом прикрепления проводят на живом материале методом фазового контраста.
Изучение хлоропластов, стигмы; окраска пиреноидов. Хлоропласты следует изучать на живом материале, так как при фиксации они деформируются. Также трудно сохранить стигму. Белковое тело пиреноида после предварительной фиксации хорошо окрашивается по Альтману. Краситель состоит из 1 части насыщенного раствора пикриновой кислоты в абсолютном этиловом спирте, 7 частей 50%-го этилового спирта и 1 части насыщенного водного раствора фуксина. Окрашивание длится не менее 2 ч. Окраску белковых тел пиреноидов можно осуществить и без предварительной фиксации материала с помощью уксусного азокармина С. К 4 мл ледяной уксусной кислоты добавляют 55 мл воды и 5 г азокармина С. Полученную смесь кипятят около часа, пользуясь обратным холодильником, охлаждают, фильтруют и хранят в сосуде из темного стекла. Раствор красителя добавляют в каплю воды с водорослями на предметном стекле, накрывают покровным стеклом и наблюдают под микроскопом. Белковое тело пиреноида окрашивается в интенсивный красный цвет, остальная часть клетки - в светло-розовый (рис. 7.8, 4).
Выявление ассимилятов. Крахмал окрашивается в синий цвет под воздействием любых реактивов, содержащих иод. Наиболее чувствительный из них - хлорал иода (мелкие кристаллики иода в растворе хлоралгидрата) - позволяет обнаружить наиболее мелкие зернышки крахмала и отличить крахмал вокруг пиреноида от строматического (рис. 7.8, 5, 6). Присутствие парамилона можно обнаружить, растворяя его 4%-м КОН. Наличие хризоламинарина выявляется лишь с помощью очень сложных микрохимических реакций. Масло и жиры окрашиваются суданом III (0,1 г Судана III в 20 мл абсолютного этилового спирта) в красный цвет или оксидом осмия (IV) - в черный (рис. 7.8, 7).
Изучение вакуолей. Вакуоли с клеточным соком становятся более заметными благодаря прижизненной окраске слабым раствором нейтрального красного. Пульсирующие вакуоли можно наблюдать на живом материале в световом микроскопе благодаря их периодическому наполнению и опорожнению. Применение фазово-контрастного устройства, добавление 1%-го водного раствора танина, а также фиксация материала оксидом осмия (IV) облегчают выявление этих органелл.
Окраска митохондрий. Митохондрии хорошо окрашиваются при свободном доступе кислорода 0,1%-м раствором зелени Януса (рис. 7.8, 8). Поэтому каплю воды с водорослями на предметном стекле накрывают покровным стеклом лишь спустя некоторое время после добавления красителя.
Окраска аппарата Гольджи. Аппарат Гольджи при фиксации материала оксидом осмия (IV) темнеет. Его можно окрасить также 0,5%-м водным раствором трипанового голубого; 0,01%-й водный раствор метиленового голубого окрашивает содержимое клетки в синий цвет, в то время как аппарат Гольджи остается бесцветным.
Методы изготовления постоянных препаратов
Для изготовления постоянных препаратов используют глицерин-желатину. Одну весовую часть желатины настаивают в 6 весовых частях дистиллированной воды на протяжении нескольких часов, затем добавляют 7 весовых частей чистого глицерина и кристаллик антисептика, например, тимола или карболовой кислоты. Смесь нагревают на водяной бане, помешивая стеклянной палочкой, до полного растворения желатины. Для осаждения мути прибавляют сырой яичный белок и фильтруют через бумажный фильтр, пользуясь воронкой для горячего фильтрования и часто меняя бумагу. Остывшая глицерин-желатина должна быть прозрачной. При употреблении ее расплавляют нагреванием на водяной бане. Эта среда хорошо смешивается с водой, поэтому при ее применении отпадает необходимость в продолжительной сушке материала.
Препараты готовят следующим образом: водоросли из воды переносят в каплю глицерина и на некоторое время оставляют подсохнуть; затем каплю расплавленной глицерин-желатины наносят на нагретое предметное стекло, переносят в нее водоросли и накрывают покровным стеклом; после полного застывания глицерин-желатины края покровного стекла покрывают лаком. Такие препараты можно хранить в горизонтальном положении в течении нескольких лет.
Еще дольше сохраняются препараты, заключенные в канадский бальзам или в синтетические смолы на метилметакрилатной основе. Последние быстро твердеют, прозрачны, химически нейтральны и обладают подходящим индексом светопреломления. Перед заключением в канадский бальзам или синтетические смолы материал должен быть полностью обезвожен проводкой через спирты возрастающей крепости до абсолютного и гвоздичное масло или ксилол, которые способствуют его просветлению. Материал, окрашенный методом Гимза, помещают в кедровое масло, со временем застывающее, в котором краски сохраняются неограниченно долго.
Особые методы изготовления препаратов применяют при изучении Bacillariophyta, Dinophyta и Desmidiales, систематика которых базируется на структуре клеточных покровов (см. [42, 106]). Подготовка диатомовых к микроскопированию заключается в уничтожении всех органических веществ, затемняющих структуру панциря. Это достигается либо прокаливанием материала, либо обработкой его концентрированными минеральными кислотами, в частности серной кислотой. При использовании первого метода каплю суспензии, освобожденную от примесей и содержащую клетки диатомовых, наносят на чистое обезжиренное покровное стекло, подсушивают и, поместив на слюдяную пластинку, прокаливают над пламенем горелки или на электрической плитке до полного сгорания всех органических веществ (в течение получаса и более). При изучении бентосных диатомей, обладающих мощными панцирями, прокаливание проводят в электропечи при температуре 450°С. Если покровные стекла при продолжительном нагревании плавятся, материал прокаливают на слюдяных пластинках, а затем переносят на покровные стекла. Метод прокаливания позволяет сохранить наиболее мелкие и нежные панцири планктонных видов, не нарушает естественное расположение клеток в колонии, требует небольшого количества исследуемого материала. Однако образцы, загрязненные большим количеством органических веществ, лучше обрабатывать химическим способом.
При холодной обработке кислотами пробы предварительно очищают от грубых органических и минеральных примесей на часовых стеклах, отмывают от формалина и солей дистиллированной водой путем отстаивания или центрифугирования. Полученный осадок на несколько суток заливают концентрированной серной кислотой, затем добавляют несколько кристаллов дихромата или нитрата калия и несколько раз промывают дистиллированной водой с последующим центрифугированием до полного отмывания от кислоты.
Наряду с холодным методом применяют горячую обработку кислотами. При этом водоросли предварительно кипятят в течение 10-15 с в разбавленной соляной кислоте, а затем отмывают от нее. Полученный осадок с минимальным количеством воды переносят в колбу, добавляют четырех-пятикратное по объему количество концентрированной серной или азотной кислоты, заполняя колбу не более чем наполовину, и кипятят на водяной или песчаной бане под вытяжкой в течение 15 мин - 1 ч. Побуревшую массу осветляют добавлением кристаллов KNO3. После ее охлаждения осадок пипеткой переносят в пробирку с водой, осторожно добавляя кислоту с диатомовыми в воду, чтобы избежать вскипания и разбрызгивания кислоты, и отмывают осадок до нейтральной реакции.
Полученный после прокаливания или обработки кислотами материал консервируют 2-3%-м формальдегидом для последующего хранения или непосредственно используют для изготовления постоянных препаратов. С этой целью на тонкие, чистые, обезжиренные покровные стекла наносят суспензию с клетками диатомей и высушивают. На предметное стекло помещают небольшое количество синтетической смолы (плевракс, гиракс и др.) с индексом светопреломления выше 1,6, растапливают ее над пламенем горелки и накрывают покровным стеклом с исследуемым материалом, осторожно надавливая на него и разравнивая среду тонким равномерным слоем. Излишки среды снимают с помощью ксилола.
Диатомовые, обладающие очень тонкими и нежными панцирями, изучают на сухих препаратах с воздушной средой. Для их изготовления суспензию с клетками диатомовых наносят на покровное стекло, высушивают, кладут на предметное стекло и заклеивают по краям лаком.
При изучении Desmidiales и панцирных Dinophyta материал обрабатывают жавелевой водой, способствующей его осветлению. Для приготовления жавелевой воды в 100 частях воды растирают 20 частей хлорной извести, доливают 100 частей 15%-го раствора карбоната калия и отстаивают в течение нескольких часов, после чего смесь многократно взбалтывают. К фильтрату постепенно добавляют раствор карбоната калия до прекращения появления осадка. После повторной фильтрации жидкость сливают в плотно закрывающийся сосуд из темного стекла и хранят в темноте. Исследуемый материал осаждают центрифугированием, осадок заливают на 1-2 суток жавелевой водой, плотно закрывая сосуд пробкой. Обработанный таким образом материал 2-3 раза отмывают дистиллированной водой. Панцири динофитовых для выявления их структуры рекомендуют после просветления жавелевой водой подкрашивать трипановым голубым или спиртовым раствором иода.
Для декальцинирования водорослей, инкрустированных известью (например, Charophyceae), или живущих в известковых породах (сверлящие водоросли), применяют молочную кислоту, способствующую также просветлению препарата, а при отсутствии ее используют соляную кислоту.
Методы измерения размеров водорослей
При изучении видового состава водорослей измеряют их размеры, являющиеся важными диагностическими признаками. Для измерения микроскопических объектов применяют окуляр-микрометр с измерительной линейкой (рис. 7.9). Цену делений окуляр-микрометра определяют с помощью объект-микрометра (предметное стекло с нанесенной на ней линейкой, цена каждого деления которой 10 мкм; рис. 7.9), индивидуально для каждого микроскопа и объектива (подробнее см. [239, вып. 1, с. 158-162]). При изучении линейных размеров водорослей желательно проводить измерения возможно большего количества экземпляров (10-100) с последующей статистической обработкой полученных данных [181, 256, 271].
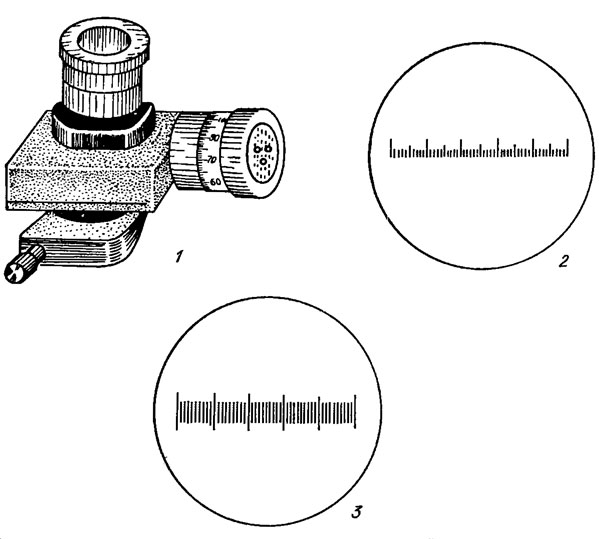
Рис. 7.9. Окуляр-микрометр (1), измерительная линейка окуляр-микрометра (2) и линейка объект-микрометра (3)
Все изучаемые объекты следует тщательно зарисовывать с помощью рисовальных аппаратов (РА-4, РА-5) и параллельно фотографировать, пользуясь микрофотонасадкой (МФН-1, МФН-2).
При идентификации водорослей следует добиваться точности определения. Изучая оригинальный материал, необходимо отмечать любые, даже незначительные отклонения от диагноза в размерах, форме и других морфологических особенностях, фиксировать их в своих описаниях, на рисунках, микрофотографиях.
При качественной обработке проб желательно определить частоту встречаемости отдельных видов, пользуясь для этого условными обозначениями. Существуют различные шкалы для оценки частоты встречаемости водорослей. В качестве примера ниже приводится шкала Стармаха [650]: + - очень редко (вид присутствует не в каждом препарате); 1 - единично (1-6 экземпляров в препарате); 2 - мало (7-16 экземпляров в препарате); 3 - порядочно (17-30 экземпляров в препарате); 4 - много (31-50 экземпляров в препарате); 5 - очень много, абсолютное преобладание (более 50 экземпляров в препарате).
Все шире в практике альгологических исследований используется трансмиссионная и сканирующая электронная микроскопия. Методы подготовки препаратов и изучения их с помощью трансмиссионного и сканирующего электронного микроскопа описаны в специальной литературе [27, 130, 183, 228, 262, 308, 627].
Методы количественного учета водорослей
Количественному учету могут подвергаться только количественные пробы фитопланктона, фитобентоса и перифитона. Данные о численности водорослей являются исходными для определения их биомассы и пересчета других количественных показателей (содержания пигментов, белков, жиров, углеводов, витаминов, нуклеиновых кислот, зольных элементов, интенсивности дыхания, фотосинтеза и т. д.) на одну клетку или на единицу биомассы. Численность водорослей может быть выражена в количестве клеток, ценобиев, колоний, отрезков нитей определенной длины и др.
Подсчет численности водорослей осуществляют на специальных счетных стеклах (разграфленных на полосы и квадраты), на поверхность которых штемпель-пипеткой (рис. 7.10, 1) определенного объема (большей частью 0,1 см3) наносят каплю воды из тщательно перемешанной исследуемой пробы. При отсутствии счетного стекла можно пользоваться обычным предметным стеклом при условии перемещения его на столике микроскопа с помощью препаратоводителя. Если нет штемпель-пипетки, используют обычную градуированную пипетку, отрезав нижнюю оттянутую ее часть, чтобы сделать входное отверстие шире. Для учета численности водорослей применяют также счетные камеры Нажотта объемом 0,01 см3 (рис. 7.10, 2), "Учинскую" (0,02 см3) и др. Можно пользоваться также камерами, применяемыми для подсчета форменных элементов крови - Горяева, объемом 0,9 мм3 (рис. 7.10, 3, 4), Фукса-Розенталя и др. При использовании камер Горяева и Фукса-Розенталя покровное стекло тщательно притирают к боковым поверхностям предметного счетного стекла до появления колец Ньютона, а затем заполняют камеру каплей исследуемой пробы с помощью пипетки. В зависимости от количества организмов в исследуемой пробе можно просчитывать либо все, либо часть дорожек (квадратов) на поверхности счетного стекла. Необходимо обязательно проводить повторные подсчеты нескольких (не менее трех) капель из одной и той же пробы, каждый раз отбирая пипеткой образец для подсчета после тщательного взбалтывания пробы.
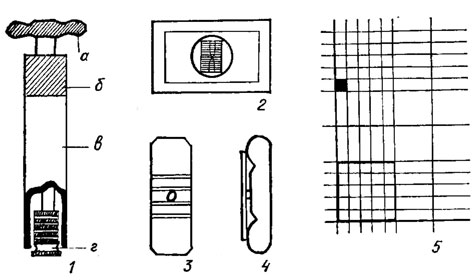
Рис. 7.10. Приборы, применяемые при количественном учете водорослей: 1 - штемпель-пипетка ( а - ручка; б - металлическая обойма); в - стеклянная трубка; г - катушка с выемкой определенного объема); 2 - счетная камера Нажотта; 3, 4 - счетная камера Горяева (3 - вид сверху, 4 - вид сбоку); 5 - фрагмент сетки, на которой производится подсчет клеток водорослей
Расчет численности фитопланктона. При исследовании количественных проб фитоплактона (или культуральной суспензии водорослей) пересчет численности организмов на 1 л воды производят по формуле
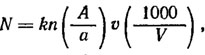
где N - количество организмов в 1 л воды исследуемого водоема (культуральной жидкости); k - коэффициент, показывающий во сколько раз объем счетной камеры меньше 1 см3; n - количество организмов, обнаруженных на просмотренных дорожках (квадратах); А - количество дорожек (квадратов) на счетной пластинке (в камере); а - количество дорожек (квадратов), на которых производился подсчет водорослей; V - первоначальный объем отобранной пробы (см3); υ - объем сгущенной пробы (см3).
Расчет численности бентоса и перифитона. При изучении количественных проб фитобентоса и перифитона, в которых обычно преобладают сравнительно крупные организмы, пользуются преимущественно штемпель-пипеткой объемом 0,1 см3. Расчет численности водорослей в пробах бентоса и перифитона ведут на 10 см2 поверхности субстрата по формуле
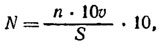
где N - количество организмов на 10 см2 поверхности субстрата; n - число организмов в просчитанной капле воды объемом 0,1 см3; υ - объем пробы (см3); 5 - площадь сечения трубки в микробентометре (для бентосных проб) или площадь поверхности субстрата, с которого смыты водоросли (для проб обрастаний) (см2).
Расчет численности эпифитных водорослей. При изучении эпифитных водорослей их численность, кроме того, рассчитывают на 1 г сырой (или воздушно-сухой) массы растения-субстрата по следующей формуле:
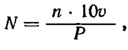
где N - число организмов на 1 г сырой (воздушно-сухой) массы растения- субстрата; n - число организмов в просчитанной капле воды объемом 0,1 см3; υ - объем пробы (см3); Р - сырая или воздушно-сухая масса (г) того участка растения-субстрата, с которого были смыты эпифиты.
Количественное содержание водорослей в пробах наиболее полно отражают показатели их биомассы, которые определяют с помощью счетнообъемного, весового, объемного, разнообразных химических (радиоуглеродного, хлорофиллового и др.) методов.
Определение биомассы. Для определения биомассы водорослей счетно-объемным методом необходимо располагать данными об их численности в каждой конкретной пробе для каждого вида отдельно и их средних объемах (для каждого вида из каждой конкретной пробы). Существуют разные методы определения объема тела водорослей [135, с. 317-318]. Наиболее точным считается стереометрический метод, при использовании которого тело водоросли приравнивается к какому-нибудь геометрическому телу или комбинации таких тел, после чего объемы их вычисляют по известным в геометрии формулам на основании линейных размеров конкретных организмов. Иногда пользуются готовыми, вычисленными ранее средними объемами тела для разных видов водорослей, которые приводятся в работах многих авторов (см. библиографические ссылки в работе [135] на с. 318). Относительную плотность по воде пресноводных водорослей принимают обычно за 1,0-1,05, гипергалобных - за 1,1-1,2. Биомассу рассчитывают для каждого вида отдельно, а затем суммируют. Счетно-объемный метод определения биомассы широко используют в практике гидробиологических исследований при изучении количественных соотношений различных компонентов биоценозов, закономерностей распределения водорослей в различных биотопах одного и того же водоема или в разных водоемах, сезонной и многолетней динамики развития водорослей и др.
При интенсивном развитии водорослей можно пользоваться весовым методом. При этом исследуемую пробу фильтруют через предварительно высушенный и взвешенный бумажный фильтр (параллельно через контрольные фильтры фильтруют дистиллированную воду). Затем фильтры взвешивают и сушат в сушильном шкафу при 100°С до постоянной массы. На основании полученных данных вычисляют сухую и сырую массу осадка. В дальнейшем путем сжигания фильтров в муфельной печи можно определить содержание в осадке органических веществ.
Недостатки этого метода заключаются в том, что он дает представление лишь о суммарной массе всех взвешенных в пробе органических и неорганических веществ, живых организмов и неживых примесей, животного и растительного происхождения. Вклад представителей отдельных таксонов в эту суммарную массу можно лишь приблизительно выразить в массовых долях после подсчета под микроскопом их соотношения в нескольких полях зрения.
Наиболее полное представление о биомассе водорослей можно получить, сочетая несколько разных методов исследования.
|
ПОИСК:
|
© VOLIMO.RU, 2010-2019
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'