
Прямые методы количественного учета почвенных водорослей
Приготовление препарата для прямого учета микроскопических водорослей среди почвенных частиц состоит в следующем (Штина, 1956). Навеску почвы растирают в склянке, с добавлением небольшого количества воды (если счет ведется в свежевзятой почве) или в том объеме формалина, в котором была зафиксирована почва. Для растирания используют пестик, изготовленный из препаровальной иглы с резиновым наконечником, вырезанным пробочным сверлом. Затем добавляют воду, доводя объем суспензии до 4 мл, и тщательно взбалтывают в течение 2 мин. После полуминутного отстаивания взвесь над осадком сливают в центрифужную пробирку. К осадку добавляют 3 мл воды, взбалтывают 1 мин, отстаивают 30 сек и взвесь сливают в ту же центрифужную пробирку. Процедуру повторяют еще раз. После этого осадок отбрасывают.
В зависимости от механического состава почвы и особенностей распределения в ней водорослей время растирания, взбалтывания и отстаивания можно менять, добиваясь, чтобы осадок не содержал водорослей.
Суспензию, слитую в центрифужную пробирку, разливают по нескольким пробиркам и центрифугируют 1 мин 500 g/мин. Осадок доводят до объема 10 или 20 мл, иногда до 40 мл в зависимости от густоты суспензии.
Каплю суспензии после тщательного перемешивания в пробирке (не менее 1 мин) помещают на предметное стекло. Для отбора капли используют мерные пипетки со слегка подточенным носиком. Следует нанести на предметное стекло одну из первых капель, пока не нарушена гомогенность суспензии.
Нанося каплю суспензии, подсчитывают число капель в одном мл и определяют таким образом ее объем. Для замедления подсыхания препарата в каплю суспензии можно добавить каплю глицерина, перемешивая смесь краем покровного стекла и добиваясь равномерного распределения водорослей в препарате. Каплю закрывают покровным стеклом. Препарат готов для микроскопирования.
Приготовленный к счету препарат просматривают: при люминесцентном освещении, если почва свежая, или при обычном освещении микроскопа, воли почва фиксирована формалином. Можно считать водоросли не во всей капле, а только в части ее, просматривая, например, каждую вторую или каждую пятую полосу, равную по ширине диаметру поля зрения. Число, просчитываемых полос устанавливается эмпирически в зависимости от разведения суспензии и количества водорослей в ней. Отмечают число встреченных в препарате водорослей, отдельно по систематическим группам: синезеленне (цианобактерии), зеленые и желтозеленне (вместе), диатомовые. При наличия многоклеточных форм указывают число особей и число клеток. Можно сразу измерять обнаруженные клетки и нити для последующего определения их объема и расчета биомассы. Для этого используют окуляр-микрометр. Цену линейки определяют с помощью объект-микрометра.
Люминесцентный метод учета клеток водорослей (Помелова, 1969, 1971). При просмотре почвенной суспензии под люминесцентным микроскопом водорослевые клетки выявляются за счет красного (на черном поле) свечения, обусловленного естественной флуоресценцией хлорофилла. Используются люминесцентные микроскопы MЛ-1, МЛ-2, МЛ-4. Наблюдения проводят в отраженном свете при максимально открытых полевой и апертурной диафрагмах. Для возбуждения флуоресценции используют свет с максимумом 365 мкм. Разграничение водорослей по группам достигается просмотром препарата под микроскопом при переключении света люминесценции на проходящий свет.
Используя люминесцентный микроскоп, можно упростить процедуру подготовки почвенной пробы к счету, в частности, исключить процедуры отмучивания и центрифугирования.
Предложен другой метод приготовления препаратов для люминесцентной микроскопии (Кожевин, 1989). Почвенную суспензию обрабатывают на ультразвуковом диспергаторе (2 кГц, 44 А, 2 мин), наносят на тщательно обезжиренное предметное стекло (0,01 мл на препарат) и равномерно распределяют по площади 4 см2 (квадрат 2×2 см). При данной площади на каждом стекле можно приготовить 3 препарата. Препараты высушивают на воздухе при комнатной температуре, фиксируют их легким нагреванием и микроскопируют. Число водорослей в 1 г почвы рассчитывают по формуле
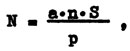
где a - среднее число клеток в поле зрения; p - площадь поля зрения (мкм2); n - показатель разведения; S - площадь мазка.
В данном случае площадь мазка S = 4 см2 = 4·108 мкм2. Тогда формула имеет вид
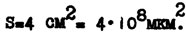
При отсутствии люминесцентного микроскопа можно использовать люминесцентные приставки ОИ-17, ОИ-18. Хорошее свечение клеток наблюдается при использовании светофильтров СФ-1, теплозащитного СЗЗ-7, запирающего KC-18. Нельзя использовать для счета в люминесцентном микроскопе пробы, зафиксированные формалином, так как формалин "гасит" естественную флуоресценцию клеток водорослей.
Принцип кинетического метода определения биомассы микроорганизмов (Паников, Мирчинк, 1985) в почве состоит в следующем. Скорость любого микробиологического процесса зависит в основном от трех факторов: количества (биомассы) микроорганизмов, концентрации субстрата данного процесса и условий его протекания. Если в почву внести субстрат в насыщенной концентрации, а условия жизнедеятельности микробного населения (влажность, температуру, газообмен с воздухом) поддерживать на постоянном оптимальном уровне, то скорость процесса будет пропорциональна количеству микроорганизмов. Тогда X = V/Q, где X - количество микроорганизмов, V - скорость процесса, Q - коэффициент пропорциональности есть одновременно и пересчетный коэффициент от скорости к биомассе. По своему биологическому смыслу Q является удельной скоростью превращения субстрата. 6 микроскопической кинетике существуют функциональные отношения между Q, удельной скоростью 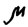 и экономическим коэффициентом или выходом биомассы по субстрату Y:
и экономическим коэффициентом или выходом биомассы по субстрату Y:
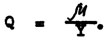
Для того, чтобы найти численные значения Q, 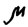 , Y для конкретной почвы, ставят эксперимент, в котором после внесения субстрата микроорганизмам "дают возможность" подрасти. При этом в динамике измеряют скорость потребления субстрата (она растет экспоненциально при неограниченных ресурсах питательных веществ), а также стехиометрические соотношения между субстратами и продуктами микробного роста. По динамике V находят
, Y для конкретной почвы, ставят эксперимент, в котором после внесения субстрата микроорганизмам "дают возможность" подрасти. При этом в динамике измеряют скорость потребления субстрата (она растет экспоненциально при неограниченных ресурсах питательных веществ), а также стехиометрические соотношения между субстратами и продуктами микробного роста. По динамике V находят 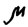 , а по стехиометрии процесса Y.
, а по стехиометрии процесса Y.
Для почвенных водорослей одним из ростовых субстратов будет CO2. Специфическим метаболическим процессом служит интенсивность фотоассимиляции CO2 Vф. Так как в случае водорослей величина 1 равна единице (поскольку измеряется не истинная, а кажущаяся скорость фотоассимиляции за вычетом фотодахания и прижизненных выделений), то биомасса водорослей рассчитывается по уравнению:
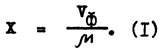
Для определения биомассы водорослей кинетическим методом (Дедыш и др., 1990) почву или породу с водорослевыми разрастаниями инкубируют в закрытых стеклянных флаконах при освещении 10 кл с избыточным количеством CO2 (до 1%). Скорость фотоассимиляции CO2 (Vф) измеряют по разнице между скоростью выделения CO2 в темноте (под непрозрачным экраном из черной бумаги) и на свету. Для этого флаконы герметично закрывают и измеряют прирост концентрации CO2 в воздушной фазе в темноте в течение 0,5-1 ч. Затем удаляют экран и в ходе инкубации на свету регистрируют динамику потребления CO2 в течение 1 ч. Интенсивность фотосинтеза Vф рассчитывают по формуле:
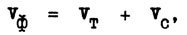
где VT - скорость выделения CO2 в темноте (интенсивность дыхания почвы) и VC - скорость потребления CO2 на свету. Повторность опыта трехкратная.
Концентрацию CO2 определяют на газовом хроматографе Хром-41 с катарометром в качестве детектора, газ-носитель - Не (25 мл/мин), колонки с адсорбентом Parapak Q из нержавеющей стали 300 0,3 см.
Удельная скорость фотосинтеза водорослей рассчитывается как тангенс угла наклона линеаризованной кривой скорости фотосинтеза в полулогарифмических координатах: "lnVф - t":
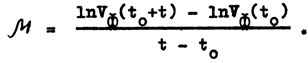
Далее, по формуле (I) производят пересчет на биомассу водорослей (в мг C/ на вес образца). Последующие пересчеты осуществляются, исходя из того, что с составляет 50% от сухого вещества, а сухое вещество водорослей составляет 15% от их сырой биомассы.
Кинетический расчет биомассы водорослей в почве по скорости фотосинтеза оказывается вполне приемлимым для количественных альгологических исследований. К преимуществам метода следует отнести его быстроту, точность, неизмеримо меньшую трудоемкость по сравнению с прямыми микроскопическими методами. Среди недостатков необходимо отметить невозможность качественных исследований альгофлоры, а также его неприменимость в случае, когда кроме водорослей в образце почвы есть другие фотосинтезирующие организмы - мхи, лишайники, высшие растения. Нижняя: граница применимости предлагаемого метода составляет 5 мкг C биомассы/г почвы, что соответствует ситуации, когда отдельные клетки водорослей диффузно рассеяны в толще почвы. Однако при работе в интервале 5-50 мкг С/г почвы ошибка определения может быть довольно значительной. Основной "рабочий" интервал, в котором метод дает точные и хорошо воспроизводимые данные - от 50 мкг C вещества водорослей на 1 г почвы и выше.
Результаты определения биомассы водорослей методом люминесцентной микроскопии для альгобактериальных ценозов на поверхности известняков совпадали с результатами определения биомассы фототрофного компонента этих ценозов кинетическим методом (табл. 3)

Таблица 3. Биомасса водорослей в альгобактериальном ценозе на известняке (г сухой массы/г породы)
Определение длины нитей у нитчатых водорослей. Показатель длины нитей у нитчатых водорослей впервые использован (Гаель, Штина, 1974) для оценки противоэрозионной роли почвенных водорослей. Этот показатель успешно применяется при анализе поверхностных разрастаний на песках, промышленных отвалах и горных склонах.
Длина нитей нитчатых водорослей определяется под оптическим микроскопом с помощью окуляр-микрометра. Расчет проводят по формуле:
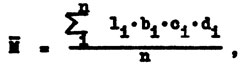
где M̄ - средняя длина нитей нитчатых водорослей в 1 г почвы при ее исходной влажности, мкм; li - длина нитей нитчатых водорослей, измеренная под микроскопом в результате i-го просмотра, мкм; bi - количество капель в 1 мл почвенной суспензии при i-й повторности; ci - часть просмотренной капли при i-ом просмотре; di - i-й объем почвенной суспензии, мл; n - число наблюдений.
Определение проективного покрытия почвы водорослями. Проективное покрытие показывает, какую часть поверхности почвы занимают водоросли. Степень покрытия выражается в процентах или долях от единицы. Показатель "проективное покрытие" используется при различных количественных исследованиях, при определении биомассы и продукции водорослей. При наличии визуально заметных разрастаний водорослей степень покрытия ими почвы определяется глазомерно или картированием. Есть попытки применять более точные способы оценки площади покрытия с помощью геоботанических рамок. Существует метод (Домрачева, Штина, 1985), при котором определяют степень покрытия почвы водорослями при "цветении" на каждом квадратном сантиметре. Для этого вычисляют площади поверхности всех встреченных при счете клеток водорослей, приравнивая клетки к геометрическим фигурам.
Для просчета водорослей в поверхностных разрастаниях используют также метод прямого счета под люминесцентным микроскопом, применяя модификацию метода Штиной, при которой водоросли учитывают в сухом мазке.
|
ПОИСК:
|
© VOLIMO.RU, 2010-2019
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'