
Глава V. Методы сбора и изучения водорослей
1. Сбор водорослей
(Как уже было оговорено в предисловии, в данном выпуске "Определителя" нет возможности дать полное представление о всех методах полевых исследований водорослей, особенно преследующих гидробиологические цели. Подробные сведения можно получить в следующих работах: 1) В. М. Рылов. Краткое руководство к исследованию пресноводного планктона. Саратов, 1926. 2) Инструкции по биологическим исследованиям вод. Под редакцией К. М. Дерюгина. Часть II. Биология материковых вод. Раздел А. Исследование бентоса, вып. 1-4. Раздел Б. Исследование планктона, вып. 1. Ленинград, 1931. 3) В. Г. Богоров. Инструкция для проведения гидробиологических работ в море (планктон и бентос). Москва - Ленинград, 1947.)
Сбор водорослей обычно не вызывает затруднений и часто не требует даже наличия каких-либо специальных приспособлений. В тех случаях, когда водоросли развиваются в большой массе, - обнаружить их легко. Если же количество их не столь значительно, - следует возможно более внимательно обследовать те места, где можно предполагать их развитие, беря соответствующие пробы даже тогда, когда невооруженным глазом их и не удается сразу заметить.
Выше, при рассмотрении основных экологических группировок водорослей, мы убедились, что они произрастают в разнообразных условиях. Поэтому для получения достаточно полного представления об альгологической флоре того или иного района необходимо тщательно исследовать разные места.
В мелких водоемах (ручьи, канавы и т. п.) сбор водорослей легко может быть осуществлен без специальных орудий лова. В более крупных бассейнах сбор многих бентосных водорослей также весьма прост. Так, для вылавливания нитчаток, образующих в своей совокупности то, что называют тиной, орудием лова может служить любая длинная палка, на конец которой, во избежание соскальзывания водорослей, полезно насадить несколько гвоздей. Однако, кроме крупных скоплений тины, нередко приходится вылавливать мелкие плавающие, стелющиеся по дну или прикрепленные к подводным предметам пленки, слизистые колонии и дерновинки, для чего удобно пользоваться специальными грабельками, ложкой, сачками из марли или кисеи и скребками с сачком, насаженными на палки (рис. 87, 1-3). Наиболее удобна складная палка, приспособленная для насадки на нее всех этих орудий лова. Для извлечения со дна водоемов крупных харовых водорослей применяется груз с зубьями, привязанный к длинной веревке (так называемая "кошка", рис. 87, 4). Нужно осматривать также подводные части стеблей камышей, тростников и других растений (вырезать части их стеблей), листья растений, растущих в воде (например, рдесты) и т. п. Последующее изучение материала под микроскопом может обнаружить здесь множество водорослей.
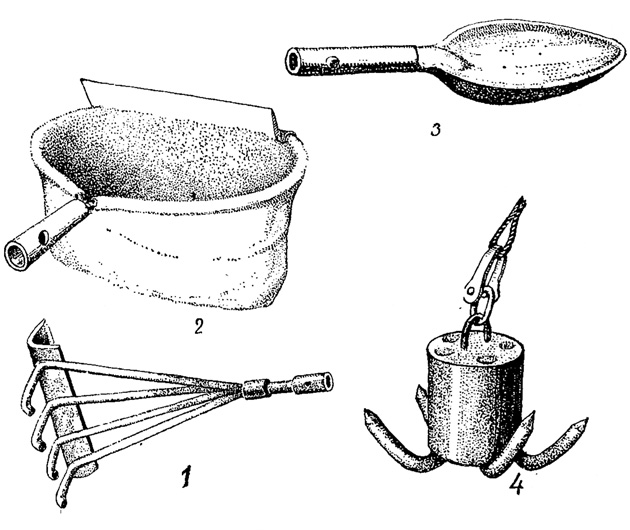
Рис. 87. Приспособления для сбора водорослей. 1 - грабельки. 2 - скребок с сачком. 3 - ложка. 4 - 'кошка'
Для сбора донного ила и содержащихся в нем водорослей используются специальные ведерки или стаканы, прикрепленные к палке или опускаемые на дно с помощью веревки, а также драги и особенно так называемые илососы (рис. 88, 89). Из них наиболее удобен илосос системы Б. В. Перфильева, устройство которого видно на рис. 88, 3-4. Основная часть этого прибора - U-образная трубка с неравными концами. Внутрь короткого колена, вставленного с помощью резиновой пробки в широкогорлую банку, впаяна тонкая трубочка, а к длинному колену прикреплен груз. На тонкую трубочку надевается длинная резиновая трубка с таким расчетом, чтобы конец ее торчал над водой, когда весь прибор будет опущен на дно. Для крепости привязывают также веревку. При опускании илососа резиновую трубку зажимают, благодаря чему вода, удерживаемая воздухом, не проникает внутрь банки. Когда длинный конец трубки уткнется в ил, - резиновую трубку открывают, давая проход воздуху, и ил с силой засасывается в банку через длинное колено.
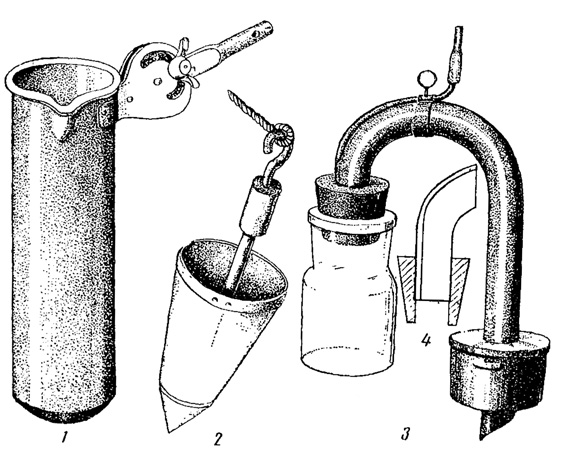
Рис. 88. Приспособления для сбора водорослей. 1 - стакан для ила. 2 - ведерко для ила. 3, 4 - илосос Перфильева: 3 - U-образная трубка, короткое колено которой вставлено в широкогорлую банку; 4 - короткое колено U-образной трубки с впаянной в него тонкой трубочкой, вставленное в пробку, замыкающую широкогорлую банку
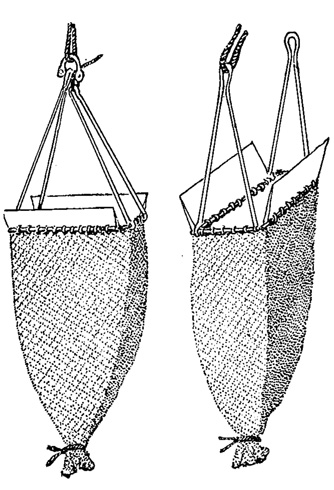
Рис. 89. Драга в разных положениях
Что касается планктона, то в случае "цветения" водоема достаточно зачерпнуть небольшое количество воды, чтобы собрать значительную массу водорослей. Однако обычно приходится применять специальные орудия лова, из которых наибольшее значение имеет планктонная сеть (рис. 90, 91). Планктонные сети делаются из специальной прочной шелковой ткани, так называемого "мельничного сита"*, обладающего очень мелкими и правильными ячеями, причем на площади в 1 см2 приходится около 6000 отверстий. Мелкие отверстия этой ткани свободно пропускают воду, но задерживают большинства микроскопических планктонных организмов (рис. 92).
* (Мельничным он называется потому, что применяется в мукомольном деле для мельничных сит, через которые отсеиваются различные сорта муки. Для изготовления планктонных сетей применяются наиболее плотные (с мелкими петлями) сорта мельничного сита, которые можно приобретать в Шелкотресте под именем "шелкового мельничного сита" № 77 или, по старой нумерации, № 25.)
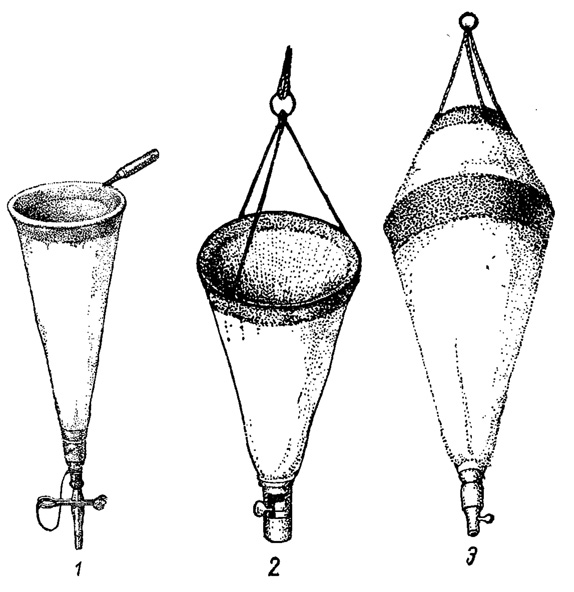
Рис. 90. Планктонные сети. 1 - сеть для лова на палке со спускной трубкой. 2 - сеть для лова на веревке со съемным стаканчиком. 3 - упрощенная количественная сеть Апштейна
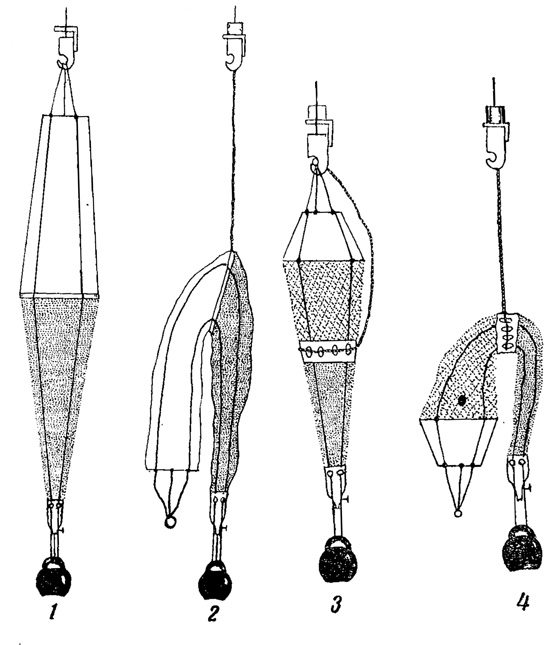
Рис. 91. Планктонные сети. 1, 2 - сеть Джеди для лова с глубины (1 - открытая, 2 - закрытая). 3, 4 - малая количественная сеть для послойного лова с глубины (5 - открытая, 4 - закрытая)
Рис. 92. Мельничное сито под микроскопом
Планктонная сеть имеет чаще форму конуса разного размера*, верхняя широкая часть которого образована металлическим кольцом с нашитым на него конусовидным мешком из мельничного сита с выходным отверстием в узкой части, внизу. Здесь находится стаканчик того или иного устройства, который можно отвинчивать или открывать с помощью зажима Мора, замыкающего резиновую трубку, надетую на выводную трубку стаканчика (рис. 90, 1, 2).
* (За последнее время широкое распространение получили также сети "Цеппелин", состоящие из трех отделов, соединенных друг с другом посредством обручей (колец), причем передний и средний отделы имеют цилиндрическую, а нижний - коническую форму. Сети "Цеппелин" наиболее удобны для горизонтального лова планктона в реках, на течении; применяются также для сбора планктона с идущего судна.)
Вся сеть прикреплена к длинной веревке или, реже, к палке*. Лов планктона лучше всего производить с лодки во время ее движения. При отсутствии лодки, планктон можно собирать и с берега, выбрав место поглубже или воспользовавшись каким-либо выдающимся в водоем пунктом - мостками, плотиной и пр. При этом сеть приходится обычно закидывать 10-20 раз. После каждого сбора ее необходимо тщательно прополоскать в воде (сняв предварительно зажим или отвинтив стаканчик), а затем высушить. Для взятия проб с глубины применяются особые захлопывающиеся сети, которые с помощью специальных приспособлений (перехватывание по середине, автоматически опускающаяся крышка) можно закрывать на любой глубине (рис. 91, 1, 2). Наконец, известны еще количественные планктонные сети, отличающиеся по внешнему виду присутствием наверху надставки из материи, имеющей форму обратно поставленного срезанного конуса (рис. 90, 3, 91 3, 4). Последняя обеспечивает равномерность фильтрования воды через сеть, вследствие чего при известной быстроте хода, она пропускает определенное, легко вычисляемое количество воды. Это позволяет, после подсчета числа организмов в пробе, сделать пересчет на единицу объема исследуемой воды**.
* (В этом случае ее удобно использовать для сбора планктона в мелких местах и среди зарослей.)
** (Следует иметь в виду, что вследствие слабой фильтрации воды через мелкоячеистую ткань данные о количестве планктонных организмов, полученные с помощью планктонной сети, являются не вполне точными.)
Для получения точного представления о составе фитопланктона, бывает нужно учитывать также те формы, которые столь мелки, что проходят через отверстия мельничного сита и поэтому не могут быть уловлены планктонной сетью. Это - так называемый наннопланктон (см. выше). Изучение его производится разными методами. Хороший результат дает центрифугирование. Для этого проба исследуемой воды переливается в специальные пробирки, помещаемые в особый прибор - центрифугу (ручную или электрическую). Центрифугирование заключается в быстром вращении вокруг вертикальной оси (1500-3000 оборотов в минуту), при котором пробирки с жидкостью ложатся горизонтально и все заключенные в ней частицы (в том числе и водоросли), благодаря центробежной силе, осаждаются на дно, откуда они и могут быть взяты для микроскопического исследования. Центрифугирование следует вообще применять в тех случаях, когда пробы планктона оказываются бедными. Кроме центрифугирования, наннопланктон может быть обнаружен и некоторыми другими методами. Из них весьма доступен, например, осадочный метод, при котором значительный объем исследуемой воды фиксируется формалином до слабого запаха, и проба, после осаждения организмов на дно сосуда, концентрируется до малого объема. Этот же метод является наиболее точным и для установления количества планктонных организмов в определенном объеме воды.
На деревьях, камнях, скалах, на сырой земле и т. п. следует собирать различно окрашенные налеты и пленки (зеленые, бурые, черные, желтые), беря их по возможности вместе с субстратом*. На торфяных болотах рекомендуется делать выжимки из торфяного мха или прополаскивать мох в воде в банке, обращая особое внимание на места, где мох доверху покрыт водой; здесь нередко развиваются пленки водорослей, которые нужно собирать непосредственно. Воду от прополаскивания или отжатую от торфяного мха лучше процеживать через мельничное сито, что способствует значительному концентрированию пробы. Для этой цели очень удобны специальные металлические стаканы, представляющие собой металлический цилиндр, дно которого образовано плотно натянутым мельничным ситом, удерживаемым с помощью металлического кольца, закреплённого винтом (рис. 93).
* (Кроме водорослей они могут быть образованы также лишайниками и протонемой мха. Последняя под микроскопом часто имеет вид зеленых ветвящихся нитей, напоминающих водоросли, но отличающихся от них косым расположением клеточных перегородок.)
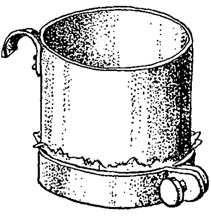
Рис. 93. Металлический стакан для концентрирования проб
Своеобразна методика сбора почвенных водорослей (эдафона). Дело в том, что почвенные водоросли, как мы уже указывали (см. выше), сравнительно редко образуют видимые простым глазом скопления, вследствие чего их приходится собирать "вслепую", т. е. брать образцы почвы, в которых водоросли не видны, с тем, чтобы впоследствии, подвергнув их специальному изучению с помощью культур (см. выше), выявить содержащуюся в них альгофлору. Для взятия почвенных проб удобно пользоваться небольшим узким металлическим совочком. Чтобы обезопасить себя от переноса водорослей с одного места на другое, совок, перед взятием пробы на каждом данном месте, следует тщательно прочищать путем многократного втыкания в почву. Можно также применять металлические трубки (диаметром около 2,5 см), из которых взятый образец почвы выталкивается металлическим стержнем. Трубку и стержень перед каждым взятием пробы следует протирать, смачивать спиртом и прожигать.
Посуда для сбора водорослей может употребляться самая разнообразная - стеклянные цилиндрики, пробирки и т. п., но удобнее всего материальные банки с корковыми пробками, емкостью в 30-50 см3*. Во избежание недостатка воздуха в воде, полезно заполнять банку не до самого верха. Однако при этом нужно остерегаться встряхивания пробы, которое может повредить некоторым наиболее нежным формам. Если встряхивания избежать нельзя (например, при переносе проб), лучше воду наливать сполна, но в этих случаях между пробкой и горлышком вставлять травинку для обеспечения прохождения воздуха. Следует избегать держать пробы на прямом солнечном свету. Если водоросли желательно дольше сохранить в живом состоянии, то лучше пользоваться крупными банками с небольшим количеством материала.
* (Почвенные пробы для исследования эдафона удобно помещать в большие пробирки или небольшие колбочки Эрленмейера, предварительно заткнутые ватными пробками и простерилизованные.)
Все собранные пробы должны быть снабжены возможно более подробными этикетками с обозначением времени и места сбора, орудия сбора и фамилии коллектора.
|
ПОИСК:
|
© VOLIMO.RU, 2010-2019
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'
При использовании материалов сайта активная ссылка обязательна:
http://volimo.ru/ 'Водоросли, лишайники, мохообразные в природе и промышленности'